Обратимые и необратимые химические процессы. Химическое и фазовое равновесии. Факторы, воздействующие на химическое равновесие. Методы управления технологическими процессами, основанные на изменении скорости химических реакций и смещении химического равновесия.
Реакция, протекающая до конца, то есть до полного израсходования одного из реагирующих веществ называется необратимой.
Например: взаимодействие алюминия с соляной кислотой идет необратимо. Обратный процесс взаимодействия хлорида алюминия и водорода с получением алюминия и соляной кислоты невозможен.
Однако большинство химических реакций протекает не до конца, когда ни одно из исходных веществ не расходуется полностью. Такие реакции называются обратимыми.
В уравнениях обратимых реакций вместо знака равенства обычно ставят разнонаправленные стрелки, которые характеризуют одновременное протекание процессов в двух взаимно противоположных направлениях:
H2 + I2 ↔ 2 HI
Согласно закону действующих масс скорость прямой реакции выражается уравнением:
v1 = k1 [ H2 ]∙ [I2],
а скорость обратной реакции — уравнением
v2 = k2 [ HI ]2
В начальный момент времени скорость синтеза HI максимальна, поскольку максимальна концентрация H2 и I2), а скорость разложения HI равна нулю, так как в системе отсутствует HI. По мере расходования водорода и иода скорость прямой реакции постепенно уменьшается, а скорость обратной, напротив, возрастает в соответствии с накоплением в реакционном объеме HI. Рано или поздно наступит такой момент, когда эти скорости станут одинаковыми: v1 = v2 и кривые скоростей сольются в горизонтальную прямую (см. рис.5). Подобное состояние системы называется химическим равновесием.
Начиная с этого момента времени, скорости v1 и v2 остаются неизменными, а значит:
k1 [ H2 ] [I2] = k2 [ HI ]2
откуда:
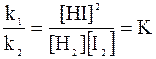
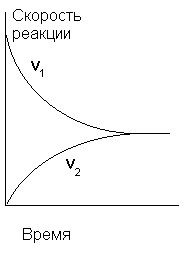 |
Рис.5. Изменение во времени скоростей прямой и обратной реакций
Отношение констант скоростей при данной температуре является также константой, называемой константой равновесия К.
Концентрации веществ, которые устанавливаются при равновесии называют равновесными концентрациями. Пока сохраняется равновесие эти концентрации остаются неизменными.
Но состояние химического равновесия не означает прекращения химических реакций. В состоянии химического равновесия взаимодействие исходных веществ и разложение продуктов реакции продолжаются с одинаковыми скоростями. Поэтому такое равновесие называется динамическим.
Для реакции общего вида:
аА +bB ↔ cC+dD
константа равновесия определяется равенством:
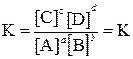
A, B, C, D – формулы веществ, а a, b, c, d – стехиометрические коэффициенты.
Константа равновесия зависит только от природы реакции и от температуры, но не зависит от механизма реакции, поэтому:
1. В уравнении константы равновесия показатели степеней, в которые возводятся концентрации участвующих в реакции веществ, всегда совпадают с коэффициентами в уравнении химической реакции.
2. Введение катализатора не изменяет константы равновесия, а только ускоряет наступление равновесия. Катализатор в одинаковой мере изменяет энергию активации прямой и обратной реакций. Поэтому отношение констант скорости прямой и обратной реакций, т.е. константа равновесия остается неизменным.
Ваша оценка?