- Сера – химический элемент и простое вещество
- История открытия
- Строение
- Физические свойства
- Какой у серы запах?
- Химические свойства
- Пожароопасные свойства серы
- Пожары на складах серы
- Продукты питания богатые серой
- Сера в организме
- Сера выполняет и множество других полезных функций, среди которых:
- Применение серы в других сферах человеческой жизни
- Интересные факты о сере
Сера – химический элемент и простое вещество

Сера – химический элемент главной подгруппы VI группы периодической системы элементов.
Эту подгруппу ещё называют халькогены. Название это произошло от двух греческих слов – «халькос», что в разных переводах значит «медь» или «руда», и «генос» – «рождаю».
Кислород и сера – это элементы, которые входят в состав многих руд металлов.
Русское слово «сера» восходит к старославянским корням, которые обозначали горючие вещества, смолы.
Латинское sulfur скорее всего произошло от индоевропейского swelp– «гореть».
Сера с древних времён использовалась жрецами храмов при проведении обрядов – она считалась произведением существ из мира духов.
Ещё в Древней Греции сера использовалась в военных действиях – она входила в состав знаменитого «греческого огня».

Алхимики считали серу отцом всех металлов – и теперь мы с вами знаем причину: большинство металлических руд представляют собой именно сульфиды.
На внешнем электронном слое серы шесть электронов, из них два – неспаренных, поэтому сера может принимать два электрона, проявляя степень окисления –2, выступая окислителем.
Но за счёт распаривания остальных четырех электронов на 3d-подуровень максимальная степень окисления серы в соединениях с более сильными окислителями (фтором, кислородом, хлором) +6.
Химически сера очень активна, но всё же встречается в природе в виде простого вещества (самородная сера).
Основной источник самородной серы – вулканический пепел и горные породы вулканического происхождения.
В большинстве случаев сера в природе встречается в виде соединений:
- пирит (железный колчедан) FeS2
- медный блеск CuS
- цинковая обманка ZnS
- гипс CaS04
- киноварь HgS
Много серы содержится в морской воде в виде английской соли MgS04 , именно она придаёт морской воде горький привкус.

Сера образует три простых вещества (аллотропные модификации):
- ромбическую
- моноклинную
- пластическую
Ромбическая сера
Наиболее устойчивая, хрупкое вещество желтого цвета.
Это именно та сера, которую мы все привыкли видеть. Сера часто встречается в домашних аптечках (применяется как пищевая добавка, а также как наружное средство при лечении кожных заболеваний), а также она используется в сельском хозяйстве для окуривания растений от паразитов и грибков.
Моноклинная сера
Менее устойчивая модификация, образуется при медленном охлаждении расплавленной серы.
Пластическая сера
Неустойчива, получить её можно, если расплавленную серу охладить резко (например, вылить в холодную воду).
Моноклинная и пластическая модификации с течением времени самопроизвольно переходят в ромбическую.
Аллотро́пия (от греческого аллос «другой» и тропос «поворот, свойство») — существование веществ одного и того же химического элемента, различных по строению и свойствам, так называемых аллотропных модификаций или форм.
Явление аллотропии обусловлено различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).

История открытия

Этот неметалл был известен человечеству с древнейших времен. Его применяли в бытовых, медицинских, и военных целях. Соединения серы использовали для отбеливания тканей, лечения кожных заболеваний, в производстве косметических средств.
Входила в состав греческого огня, зажигательного вещества, предназначавшегося для уничтожения неприятеля. Она шла на изготовление черного дымного пороха, который помимо военных целей нашел применение в производстве фейерверков.
Не обошлось и без мистики. Алхимики использовали серу для поисков философского камня. Как и всякое горючее вещество, ее считали даром божьим. Сгорание её в атмосфере сопровождалось образованием сернистого ангидрида, SO2. Этот удушливый газ обладал неприятным запахом. Точно так же неприятен был и другой газ – сероводород, H2S, источавший аромат тухлых яиц. По тогдашним представлениям такие неприятные запахи могли исходить только от самого дьявола.
В старину серу выплавляли из металлических руд, в состав которых она входила. При нагревании руды выделялось вещество, и застывало в виде светло-желтых кристаллов. Происхождение названия точно не известно. Полагают, что лат. Sulfur берет свое название от индоевропейского слова, обозначающего горючее вещество. То же самое касается и славянского «сера». Хотя некоторые считают его производным от старославянского «сира», светло-желтый.
Серосодержащие соединения принято обозначать приставкой «тио», производным от древнегреческих слов «божественный, небесный». Долгое время ее считали комплексным соединением. И лишь в XVIII в. французский химик Лавуазье доказал, что она является самостоятельным веществом, которое позднее заняло свое место в таблице Менделеева.
Строение
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
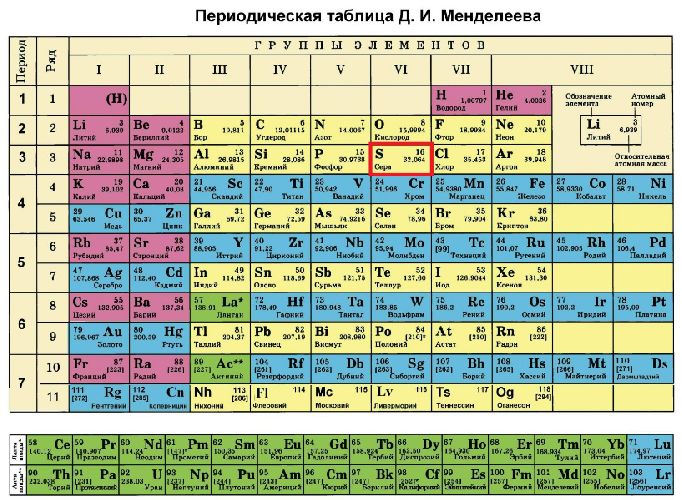
Рис. 1. Положение в периодической таблице.
Природная сера имеет несколько изотопов:
- 32S;
- 33S;
- 34S;
- 36S.
Кроме этого, искусственно получено 20 радиоактивных изотопов.
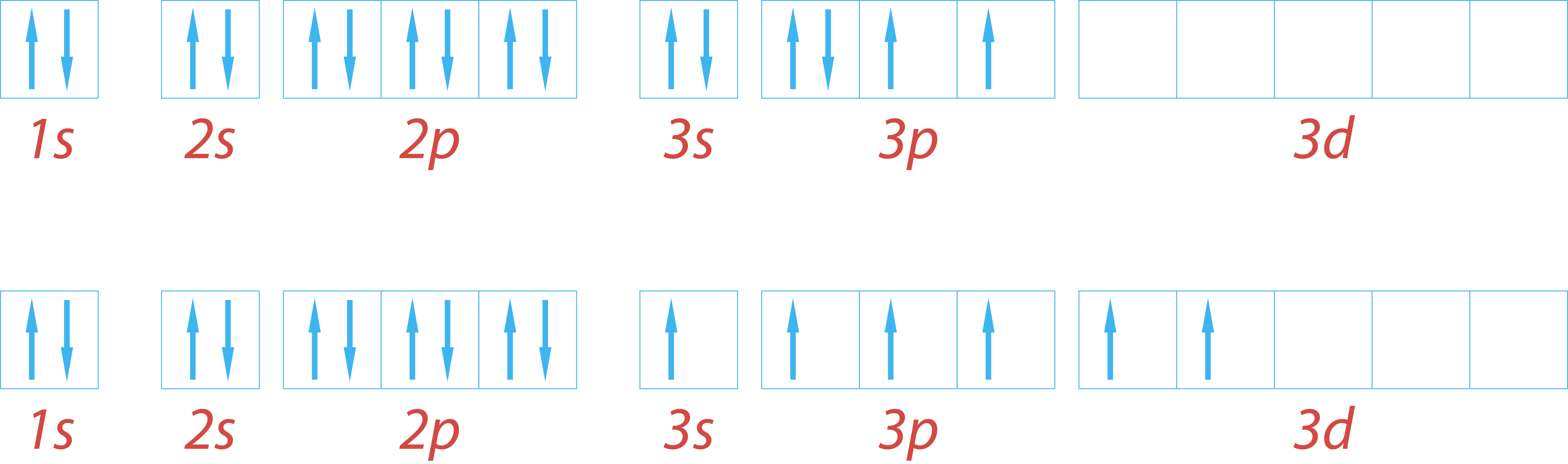
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента. До завершения внешнего р-уровня не хватает двух электронов, что определяет степень окисления серы как -2.
Атом серы может переходить в возбуждённое состояние за счёт вакантных 3d-орбиталей (всего пять d-орбиталей). Поэтому атом может проявлять степень окисления +4 и +6.
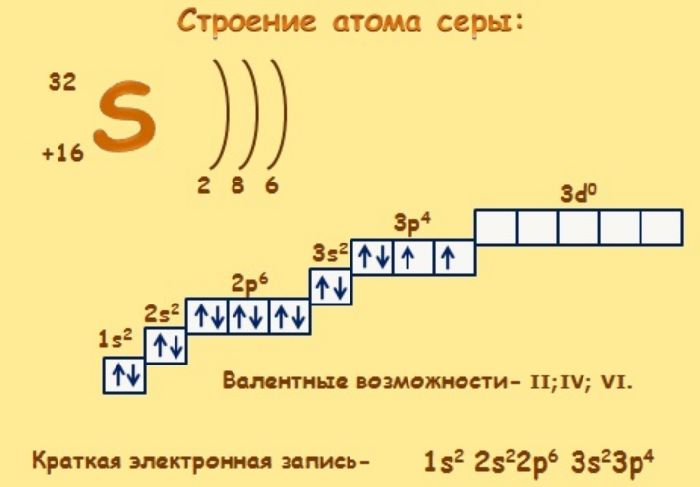
Рис. 2. Строение атома.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s22s22p63s23p4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.
 Рис. 3. Сера.
Рис. 3. Сера.
Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Какой у серы запах?
Многие соединения серы имеют душистый аромат, а запах органических газов, специфический неприятный запах у скунса, грейпфрута и чеснока происходят из-за сероорганических соединений.
- Сероводород придает характерный запах гниющим яйцам и другим биологическим процессам.
Химические свойства

Горение серы
При комнатной температуре сера реагирует со фтором и хлором, проявляя восстановительные свойства:
S + 3F2 = SF6
S + Cl2 = SCl2
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании, окисляясь:
S + 6HNO3(конц.) = H2SO4 + 6NO2 ↑ + 2H2O
S + 2H2SO4(конц.) = 3SO2 ↑ + 2H2O
На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом:
S + O2 = SO2
С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO.
При взаимодействии с металлами образует сульфиды. 2Na + S = Na2S
При добавлении к этим сульфидам серы образуются полисульфиды: Na2S + S = Na2S2
При нагревании сера реагирует с углеродом, кремнием, фосфором, водородом:
C + 2S = CS2 (сероуглерод)
Сера при нагревании растворяется в щёлочах — реакция диспропорционирования
3S + 6KOH = K2SO3 + 2K2S + 3H2O
Пожароопасные свойства серы
Тонкоизмельченная сера склонна к химическому самовозгоранию в присутствии влаги, при контакте с окислителями, а также в смеси с углем, жирами, маслами. Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью. Средства тушения: распыленная вода, воздушно-механическая пена. Обнаружение горения серы является трудной проблемой. Пламя сложно обнаружить человеческим глазом или видеокамерой, спектр голубого пламени лежит в основном в ультрафиолетовом диапазоне. Горение происходит при низкой температуре. Для обнаружения горения тепловым извещателем необходимо размещать его непосредственно близко к сере. Пламя серы не излучает в инфракрасном диапазоне. Таким образом оно не будет обнаружено распространенными инфракрасными извещателями. Ими будут обнаруживаться лишь вторичные возгорания. Пламя серы не выделяет паров воды. Таким образом детекторы ультрафиолетовых извещателей пламени, использующие соединения никеля, не будут работать. Для эффективного обнаружения пламени рекомендуется использовать ультрафиолетовые извещатели с детекторами на основе молибдена. Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы. Так как воздух по объему состоит приблизительно из 21 % кислорода и 79 % азота и при горении серы из одного объема кислорода получается один объем SO2, то максимальное теоретически возможное содержание SO2 в газовой смеси составляет 21 %. На практике горение происходит с некоторым избытком воздуха и объемное содержание SO2 в газовой смеси меньше теоретически возможного составляя обычно 14…15 %. Горение серы протекает только в расплавленном состоянии аналогично горению жидкостей. Верхний слой горящей серы кипит, создавая пары, которые образуют слабосветящееся пламя высотой до 5 см. Температура пламени при горении серы составляет 1820 °C
Пожары на складах серы
В декабре 1995 года на открытом складе серы предприятия, расположенного в городе Сомерсет Вест Западной Капской провинции Южно-Африканской Республики произошел крупный пожар, погибли два человека. 16 января 2006 г. около пяти вечера на череповецком предприятии «Аммофос» загорелся склад с серой. Общая площадь пожара — около 250-ти квадратных метров. Полностью ликвидировать его удалось лишь в начале второго ночи. Жертв и пострадавших нет. 15 марта 2007 рано утром на ООО «Балаковский завод волоконных материалов» произошел пожар на закрытом складе серы. Площадь пожара составила 20 кв.м. На пожаре работало 4 пожарных расчета с личным составом в 13 человек. Примерно через полчаса пожар был ликвидирован. Никто не пострадал. 4 и 9 марта 2008 года произошло возгорание серы в Атырауской области в хранилище серы ТШО на Тенгизском месторождении. В первом случае очаг возгорания удалось потушить быстро, во втором случае сера горела 4 часа. Объём горевших отходов нефтепереработки, к каковым по казахстанским законам отнесена сера, составил более 9 тысяч килограммов. В апреле 2008 недалеко от поселка Кряж Самарской области загорелся склад, на котором хранилось 70 тонн серы. Пожару была присвоена вторая категория сложности. К месту происшествия выехали 11 пожарных расчетов и спасатели. В тот момент, когда пожарные оказались около склада, горела еще не вся сера, а только ее небольшая часть — около 300 килограммов. Площадь возгорания вместе с участками сухой травы, прилегающими к складу, составила 80 квадратных метров. Пожарным удалось быстро сбить пламя и локализовать пожар: очаги возгорания были засыпаны землей и залиты водой. В июле 2009 в Днепродзержинске горела сера. Пожар произошел на одном из коксохимических предприятий в Баглейском районе города. Огонь охватил более восьми тонн серы. Никто из сотрудников комбината не пострадал.
Продукты питания богатые серой
Богаты серой мясные и рыбные продукты – индейка, говядина, свинина, мясо кролика, курица, говяжья и индюшачья печень, морская рыба (камбала, сардина, окунь, зубатка), перепелиные и куриные яйца, сыр, крупы и бобовые, овощи (белокочанная и брюссельская капуста, лук, чеснок, салат, репа).

Сера в организме

В виде органических и неорганических соединений Сера постоянно присутствует во всех живых организмах и является важным биогенным элементом. Ее среднее содержание в расчете на сухое вещество составляет: в морских растениях около 1,2%, наземных — 0,3%, в морских животных 0,5-2%, наземных — 0,5%.
Биологическая роль Серы определяется тем, что она входит в состав широко распространенных в живой природе соединений: аминокислот (метионин, цистеин), и следовательно белков и пептидов; коферментов (кофермент А, липоевая кислота), витаминов (биотин, тиамин), глутатиона и других. Сульфгидрилъные группы (-SH) остатков цистеина играют важную роль в структуре и каталитической активности многих ферментов.
Образуя дисульфидные связи (-S-S-) внутри отдельных полипептидных цепей и между ними, эти группы участвуют в поддержании пространственной структуры молекул белков. У животных Сера обнаружена также в виде органических сульфатов и сульфокислот — хондроитинсерной кислоты (в хрящах и костях), таурохолиевой кислоты (в желчи), гепарина, таурина.
В некоторых железосодержащих белках (например, ферродоксинах) Сера обнаружена в форме кислотолабильного сульфида. Сера способна к образованию богатых энергией связей в макроэргических соединениях.
Неорганические соединения Сера в организмах высших животных обнаружены в небольших количествах, главным образом в виде сульфатов (в крови, моче), а также роданидов (в слюне, желудочном соке, молоке, моче). Морские организмы богаче неорганическими соединениями Серы, чем пресноводные и наземные.
Для растений и многих микроорганизмов сульфат (SO42-) наряду с фосфатом и нитратом служит важнейшим источником минерального питания. Перед включением в органические соединения Сера претерпевает изменения в валентности и превращается затем в органических форму в своем наименее окисленном состоянии; таким образом Сера широко участвует в окислительно-восстановительных реакциях в клетках.
В клетках сульфаты, взаимодействуя с аденозинтрифосфатом (АТФ), превращаются в активную форму — аденилилсульфат.
Катализирующий эту реакцию фермент — сульфурилаза (АТФ:сульфат -аденилилтрансфераза) широко распространен в природе. В такой активированной форме сульфонильная группа подвергается дальнейшим превращениям — переносится на другой акцептор или восстанавливается.
Животные усваивают Серу в составе органических соединений. Автотрофные организмы получают всю Серу, содержащуюся в клетках, из неорганических соединений, главным образом в виде сульфатов. Способностью к автотрофному усвоению Серы обладают высшие растения, многие водоросли, грибы и бактерии. (Из культуры бактерий был выделен специальный белок, осуществляющий перенос сульфата через клеточную мембрану из среды в клетку.)
Большую роль в круговороте Серы в природе играют микроорганизмы — десульфурирующие бактерии и серобактерии. Многие разрабатываемые месторождения Серы — биогенного происхождения. Сера входит в состав антибиотиков (пенициллины, цефалоспорины); ее соединения используются в качестве радиозащитных средств, средств защиты растений.
Сера выполняет и множество других полезных функций, среди которых:
- Участие в синтезе инсулина – гормона, вырабатываемого поджелудочной железой и участвующих во многих обменных процессах, прежде всего, утилизации глюкозы, синтезе белков и жиров;
- Участие в синтезе гемоглобина, который помимо окрашивания крови в красный цвет обладает транспортной функцией в газообмене и переносе кровью питательных веществ ко всем органам и системам;
- Входит в состав различных аминокислот – метионина, цистеина;
- Входит в состав некоторых витаминов – витамина В1 (тиамина), витамина В7 (биотина), липоевой кислоты (синоним витамина N);
- Обладает мощным антиоксидантным действием – тормозит преждевременное окисление полезных веществ в организме, тем самым предотвращает их разложение до того, как произойдет превращение и оказание полезного действия этих веществ на организм;
- Участвует в функционировании и поддержании нормальной работы головного мозга и других элементов нервной системы;
- Обладает антигистаминным, т.е. противоаллергическим действием;
- Очень важен для формирования и роста костей, суставов, ногтей, волос, собственно, как мы уже и говорили;
- Очищает лимфатическую и кровеносную системы от токсинов и других вредных веществ;
- Подавляет выработку в организме медиаторов воспаления, за счет чего помогает ему лучше справляться с воспалительными заболеваниями различных органов;
- Участвует в репродуктивной функции;
- Тормозит старение организма.
Применение серы в других сферах человеческой жизни
- В медицинской практике – для лечения заболеваний кожи и опорно-двигательного аппарата, в качестве слабительного;
- В промышленности – для изготовления серной кислоты, вулканизации каучука, изготовления серных ламп;
- В быту – применяется для изготовления спичек, бумаги, а также обеззараживания помещений (фунгицид) и растений от вредителей;
- В строительстве – для изготовления серобетона;
- Военное дело – для изготовления взрывчатых веществ;
- Для изготовления минеральных удобрений.
Сера в чистом виде – пожароопасное вещество, которое приводило не одно десятилетие к большим пожарам по всему миру, особенно на производственных предприятиях и складах по ее хранению.
Интересные факты о сере
- Сера составляет почти 3 процента массы Земли. Это достаточно, чтобы сделать две дополнительные луны.
- Сера (как двуокись серы) использовалась для сохранения вина в течение тысячелетий и остается ингредиентом в вине сегодня, согласно Практическому Виноделию и Виноградному Журналу.
- Неясно, откуда взялось название «сера». Оно может быть получен из «суфры» или «желтого» на арабском языке. Или это может быть от санскритского «шулбари», что означает «враг меди». Второй вариант интригует, потому что сера сильно реагирует с медью. Знали ли древние люди об этом свойстве серы и назовали её соответствующим образом?
- Двуокись серы использовалась для фумигации домов с древних времен, практика, которая продолжалась и в XIX веке. Одна статья 1889 года главного инспектора здравоохранения Нью-Йорка описала, как чиновники сжигали серу и алкоголь в домах, страдающих от оспы, скарлатины, дифтерии и кори.
- Ах, расслабьтесь! Горячие источники, наполненные растворенными соединениями серы, могут иметь сомнительный запах, но они давно ценятся за их предполагаемые лечебные свойства. Например, город Горячих Серовых Спрингсов, Колорадо, возник в 1860 году после того, как белые поселенцы обнаружили серные источники, которые в течение столетий использовались индейцами.
- Подождите, что случилось с этим написанием? «Серна» — обычное правописание в Соединенном Королевстве, в то время как «сера» является предпочтительной в остальном мире. Но, с научной точки зрения, «серна» правильнее, согласно Международному союзу чистой и прикладной химии, организации, задачей которой является определить эти вещи.
- Сера может дать число на кораблекрушениях. В исследовании, проведенном в 2008 году на шведском военном корабле, затонувшем в 1628 году, было обнаружено более 2 тонн серы, пропитывающей древесные отходы спасенного судна.
- Извините! Основная причина, что кишечный газ имеет этот неприятный запах, заключается в том, что толстая кишка полна бактерий, которые выделяют соединения серы в качестве отходов.
- https://ladle.ru/education/himia/8class/sera
- https://farmamir.ru/2018/08/sera-poleznye-svojstva-dlya-cheloveka/
- https://obrazovaka.ru/himiya/stroenie-atoma-sery.html
- https://pangenes.ru/post/sera-obshchaya-harakteristika-poluchenie-himicheskie-svoystva.html
- http://himsnab-spb.ru/article/ps/s/
- https://calorizator.ru/element/s
- https://vseprokamni.ru/vidy/drugie/primenenie-sery-i-ejo-harakteristiki.html
- https://medicina.dobro-est.com/sera-s-rol-v-organizme-simptomyi-nedostatka-istochniki.html
Ваша оценка?