Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства В зависимости от типа химической реакции (гомогенная или гетерогенная) меняется характер реакционного пространства. Реакционным пространством принято называть область, в которой локализован химический процесс: объем (V), площадь (S).
Реакционным пространством гомогенных реакций является объем, заполненный реагентами. Так как отношение количества вещества к единице объема называется концентрацией (с), то скорость гомогенной реакции равна изменению концентрации исходных веществ или продуктов реакции во времени. Различают среднюю и мгновенную скорости реакции.
Средняя скорость реакции равна:
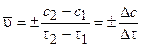 , (3.1)
, (3.1)
где с2 и с1 — концентрации исходных веществ в моменты времени t2 и t1.
Знак минус «-» в этом выражении ставится при нахождении скорости через изменение концентрации реагентов (в этом случае Dс < 0, так как со временем концентрации реагентов уменьшаются); концентрации продуктов со временем нарастают, и в этом случае используется знак плюс «+».
Скорость реакции в данный момент времени или мгновенная (истинная)скорость реакции vравна:
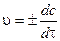 (3.2)
(3.2)
Скорость реакции в СИ имеет единицу [моль×м-3×с-1], также используются и другие единицы величины [моль×л-1×с-1], [моль×см-3 ×с-1], [моль×см –З×мин-1].
Скоростью гетерогенной химической реакции v называют, изменение количества реагирующего вещества (Dn) за единицу времени (Dt) на единице площади раздела фаз (S) и определяется по формуле:
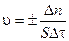 (3.3)
(3.3)
или через производную:
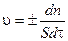 (3.4)
(3.4)
Единица скорости гетерогенной реакции — моль/м2 ×с.
Пример 1. В сосуде смешали хлор и водород. Смесь нагрели. Через 5 с концентрация хлороводорода в сосуде стала равной 0,05 моль/дм3. Определите среднюю скорость образования хлороволорода (моль/дм3 с).
Решение. Определяем изменение концентрации хлороводорода в сосуде через 5 с после начала реакции:
Dс(HCl)=c2-c1,
где с2, с1 — конечная и начальная молярная концентрация HСl.
Dс (НСl) = 0,05 — 0 = 0,05 моль/дм3.
Рассчитаем среднюю скорость образования хлороводорода, используя уравнение (3.1):
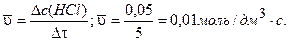
Ответ: 7 = 0,01 моль/дм3 ×с.
Пример 2. В сосуде объемом 3 дм3 протекает реакция:
C2H2 + 2H2®C2H6.
Исходная масса водорода равна 1 г. Через 2 с после начала реакции масса водорода стала равной 0,4 г. Определите среднюю скорость образования С2Н6 (моль/дм’×с).
Решение. Масса водорода, вступившего в реакцию (mпрор (H2)), равна разнице между исходной массой водорода (mисх (Н2)) и конечной массой непрореагировавшего водорода (тк (Н2)):
тпрор.(Н2)= тисх (Н2)-mк(Н2); тпрор (Н2)= 1-0,4 = 0,6 г.
Рассчитаем количество водорода:
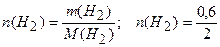 = 0,3 моль.
= 0,3 моль.
Определяем количество образовавшегося С2Н6:
— по уравнению: из 2 моль Н2 образуется ® 1 моль С2Н6;
— по условию: из 0,3 моль Н2 образуется ® х моль С2Н6.
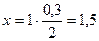 ;
;
 n(С2Н6) = 0,15 моль.
n(С2Н6) = 0,15 моль.
Вычисляем концентрацию образовавшегося С2Н6:
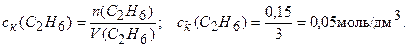
Находим изменение концентрации С2Н6:
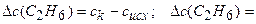 0,05-0 = 0,05 моль/дм3. Рассчитаем среднюю скорость образования С2Н6, используя уравнение (3.1):
0,05-0 = 0,05 моль/дм3. Рассчитаем среднюю скорость образования С2Н6, используя уравнение (3.1):
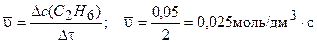 .
.
Ответ: 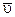 =0,025 моль/дм3 ×с.
=0,025 моль/дм3 ×с.
Факторы, влияющие на скорость химической реакции. Скорость химической реакции определяется следующими основными факторами:
1) природой реагирующих веществ (энергия активации);
2) концентрацией реагирующих веществ (закон действующих масс);
3) температурой (правило Вант-Гоффа);
4) наличием катализаторов (энергия активации);
5) давлением (реакции с участием газов);
6) степенью измельчения (реакции, протекающие с участием твердых веществ);
7) видом излучения (видимое, УФ, ИК, рентгеновское).
Зависимость скорости химической реакции от концентрации выражается основным законом химической кинетики — законом действующих масс.
Закон действующих масс. В 1865 г. профессор Н. Н. Бекетов впервые высказал гипотезу о количественной взаимосвязи между массами реагентов и временем течения реакции: «… притяжение пропорционально произведению действующих масс». Эта гипотеза нашла подтверждение в законе действия масс, который был установлен в 1867 г. двумя норвежскими химиками К. М. Гульдбергом и П. Вааге. Современная формулировка закона действия масс такова: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степе нях, равных стехиометрическим коэффициентам в уравненш реакции.
Для реакции аА + bВ = тМ + nN кинетическое уравнение за-кона действия масс имеет вид:
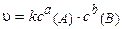 , (3.5)
, (3.5)
где 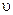 — скорость реакции;
— скорость реакции;
k — коэффициент пропорциональности, называемый константой скорости химической реакции (при 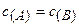 = 1 моль/дм3 k численно равна
= 1 моль/дм3 k численно равна 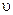 );
); 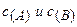 — концентрации реагентов, участвующих в реакции.
— концентрации реагентов, участвующих в реакции.
Константа скорости химической реакции не зависит от концентрации реагентов, а определяется природой реагирующих веществ и условиями протекания реакций (температурой, наличием катализатора). Для конкретной реакции, протекающей при данных условиях, константа скорости есть величина постоянная.
Пример 3. Написать кинетическое уравнение закона действия масс для реакции:
2NO (г) + С12 (г) = 2NOCl (г).
Решение. Уравнение (3.5) для данной химической реакции имеет :ледующий вид:
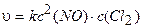 .
.
Для гетерогенных химических реакций в уравнение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой или жидкой фазах. Концентрация вещества, находящегося в твердой фазе, обычно постоянна и входит в константу скорости.
Пример 4. Написать кинетическое уравнение закона действия масс для реакций:
a)4Fe(т) + 3O2(г) = 2Fe2O3(т);
б) СаСОз (т) = СаО (т) + СО2 (г).
Решение. Уравнение (3.5) для данных реакций будет иметь следующий вид:
a)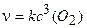 6)
6)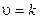
Поскольку карбонат кальция — твердое вещество, концентрация которого не изменяется в ходе реакции, т. е. в данном случае скорость реакции при определенной температуре постоянна.
Пример 5. Во сколько раз увеличится скорость реакции окисления оксида азота (II) кислородом, если концентрации реагентов увеличить в два раза?
Решение. Записываем уравнение реакции:
2NO + О2= 2NO2.
Обозначим начальные и конечные концентрации реагентов соответственно с1(NO), cl(O2) и c2(NO), c2(O2). Точно так же обозначим начальную и конечную скорости реакций: vt, v2. Тогда, используя уравнение (3.5), получим:
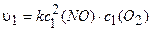 .
.
По условию с2(NO) = 2c1 (NO), с2(О2) =2с1(О2).
Находим v2 =к[2c1(NO)]2 ×2cl(O2).
Находим, во сколько раз увеличится скорость реакции:
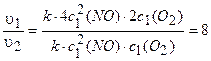
Ответ: в 8 раз.
Влияние давления на скорость химической реакции наиболее существенно для процессов с участием газов. При изменении давления в и раз в п раз уменьшается объем иn раз возрастает концентрация, и наоборот.
Пример 6. Во сколько раз возрастет скорость химической реакции между газообразными веществами, реагирующими по уравнению А + В = С, если увеличить давление в системе в 2 раза?
Решение. Используя уравнение (3.5), выражаем скорость реакции до увеличения давления:
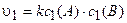 .
.
Кинетическое уравнение после увеличения давления будет иметь следующий вид:
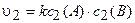 .
.
При увеличении давления в 2 раза объем газовой смеси согласно закону Бойля-Мариотта (рУ = const) уменьшится также в 2 раза. Следовательно, концентрация веществ возрастет в 2 раза.
Таким образом, с2(А) = 2c1(A), c2(B) = 2с1{В). Тогда 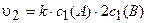
Определяем, во сколько раз возрастет скорость реакции при увеличении давления:
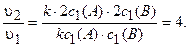
Ответ: в 4 раза.
При решении задач необходимо учитывать, что концентрации реагирующих веществ со временем уменьшаются, а концентрации продуктов растут.
Пример 7. Для реакции 4NH3 + 5О2 = 4NO + 6Н2О начальные концентрации NH3 и О2 равны соответственно 2 моль/дм3 и 3 моль/дм3- Определите их концентрации в момент времени, когда прореагирует 30 % NH3.
Решение. В подобных задачах подразумевается, что объем реакционной системы со временем не изменяется. Пусть объем системы равен 1 дм3, тогда концентрации реагентов, как следует из формулы
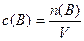 ,
,
численно равны их количествам, т. е. n(NH3) = 2 моль и n(О2) = 3 моль. Далее решаем задачу с использованием количества вещества, а затем определяем концентрации по формуле
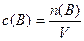 .
.
Рассчитываем количество прореагировавшего аммиака:
nпрор(NH3) = n1(NH3) ×0,3 = 2×0,3 = 0,6 моль. Тогда количество оставшегося аммиака равно:
n2 (NH3 ) = 2 — 0,6 = 1,4 моль,
а его концентрация:
c2(NH3) = 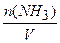 = l,4 моль /дм3.
= l,4 моль /дм3.
Находим количество прореагировавшего кислорода. Согласно уравнению реакции 4 моль NH3 реагирует с 5 моль O2, а 0,6 моль прореагировавшего NH3 будет взаимодействовать с х моль О2.
4 моль МН3 — 5 моль О2;
0,6 моль NH3 — х моль О2.
Отсюда х = 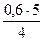 = 0,75 моль.
= 0,75 моль.
Тогда количество оставшегося кислорода равно: n2(O2)=n1(O2)-nпрор (O2)=3-0,75 = 2,25моль;
с2 (О2 )= 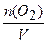 = 2,25 моль/ дм3.
= 2,25 моль/ дм3.
Ответ: 1,4 моль/дм3 NН5; 2,25 моль/дм3 О2.
Ваша оценка?