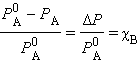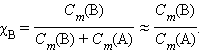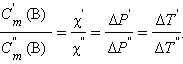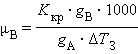Если растворенное вещество характеризуется большой упругостью пара по сравнению с упругостью пара растворителя (PB>> PA) и при этом оба компонента раствора химически инертны, то растворение такого газообразного вещества в жидкости подчиняется закону Генри: при постоянной температуре давление летучего (газообразного) компонента PB прямо пропорционально его мольной доле χB:
|
|
| (6.1) |
KH – константа Генри.
В табл. 6.1 приведены константы Генри некоторых газов для воды.
| ||||||||||||||
| Таблица 6.1. Константы Генри для воды при 298 K. |
Из уравнения (6.1) следует, что KH определяется выбором единиц давления и концентрации.
Если упругость пара растворенного вещества очень мала PB << PA, то его парциальным давлением можно пренебречь (нелетучий компонент), и тогда упругость пара над раствором будет зависеть только от парциального давления растворителя:
|
|
|
|
Это первый закон Рауля – парциальное давление над раствором прямо пропорционально мольной доле растворенного вещества. После подстановки χA = 1 – χB и несложных преобразований
|
|
|
|
получаем
|
|
|
|
Относительное понижение упругости пара над раствором равно мольной доле растворенного вещества. Это закон Рауля для нелетучего растворенного компонента. Из этого закона можно вывести два следствия, которые в объединенном виде формируются как второй закон Рауля.
|
|
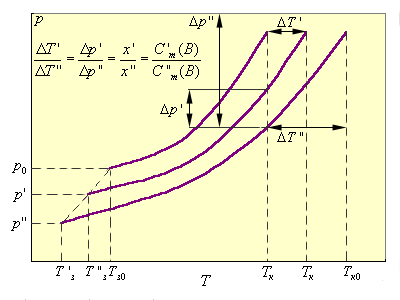
| Рисунок 6.2. Зависимость повышения температуры кипения ΔTкип и понижения температуры замерзания ΔTзам раствора от концентрации растворенного вещества. |
На рис. 6.2 приведены зависимости P(T) чистого растворителя и двух его растворов P'(T) и P»(T).
Выразим мольную долю ![]() через моляльную концентрацию
через моляльную концентрацию ![]() через моляльную концентрацию
через моляльную концентрацию Для двухкомпонентного раствора
![]()
![]()
. При
![]() << 1 получим
<< 1 получим
|
|
|
|
Из подобия треугольников следует
|
|
|
|
По определению, при ![]() (B) = 1 моль∙
(B) = 1 моль∙![]() (B) = 1 моль∙
(B) = 1 моль∙ повышение температуры
![]() равно
равно ![]() равно
равно – эбулиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
|
|
|
|
Проведя аналогичное исследование, касающееся понижения температуры замерзания раствора, получим
|
|
|
|
где Kкр – криоскопическая константа.
Второй закон Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:
|
|
|
|
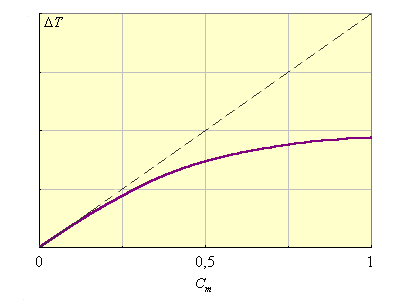
Kэб и Kкр являются экстраполяционными величинами от малых концентраций растворенного вещества, где выполняется этот закон, на Cm(B) = 1, где этот закон уже не действует (рис. 6.3). В табл. 6.2 приведены Kкр и Kэф для воды и бензола.
|
|
| Рисунок 6.3. Иллюстрация справедливости второго закона Рауля для разбавленных растворов и экстраполяционной природы Kкр и Kэб. |
| |||||||||
| Таблица 6.2. Криоскопические и эбулиоскопические константы для воды и бензола (град∙моль–1∙кг). |
Второй закон Рауля дает легко осуществимую экспериментально возможность определения молекулярных масс некоторых молекулярных соединений, неспособных к диссоциации в данном растворителе. Действительно, моляльная концентрация растворенного вещества может быть представлена в виде соотношения Cm = gB ∙ 1000 / μB ∙gA, где gA – вес растворителя, gB – вес растворенного вещества, μB – его молярная масса. Тогда из ΔT = Kкр · m получим молярную массу растворенного вещества:
|
|
|
Ваша оценка?