F > O > Csp > N, Cl > Br, Csp2 > I > C sp3 , S > H, P > Si > Mg > Li 4.0 3.5 3.2 3.0 2.8 2.6 2.5 2.1 1.8 1.2 1.0Сравнение значений ЭО атомов, образующих связь, позволяет оценить степень её полярности. Если атомы, образующие ковалентную связь равноценны, то общая электронная пара равномерно распределена между ними. Такая связь неполярна. В качестве примера можно привести связи в молекулах водорода, хлора, азота, С–С связи в молекулах этана, этилена, ацетилена. Ковалентная связь, образованная атомами с разной ЭО, является полярной, т.к. общая электронная пара смещена в сторону атома более электроотрицательного элемента. Поэтому один атом приобретает частичный положительный заряд (δ+), а другой – частичный отрицательный (δ-):
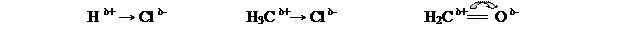 |
Характеристикой полярности связи служит её электрический дипольный момент (μ). Он равен произведению заряда на длину диполя μ═qr, измеряется в Дебаях (D). Один Дебай равен 3,34·10-30 Кл·м. Дипольный момент – величина векторная, имеет направление от положительного к отрицательному заряду и изображается стрелкой над связью. Величину дипольного момента связи можно непосредственно измерить только для двухатомных молекул. Для многоатомной молекулы можно определить лишь суммарный дипольный момент. Он является векторной суммой дипольных моментов её химических связей и неподелённых электронных пар и зависит от геометрической формы частицы. В симметрично построенных молекулах, таких как СО2, дипольный момент молекулы равен нулю. Несмотря на значительную полярность связей (2,4 D), их вектора направлены в противоположные стороны и компенсируют друг друга:
|
Примером полярных молекул служат молекулы H2O, NH3, CH3Cl. В них μ отдельных связей определяется векторным вычитанием (рис. 29).
 |
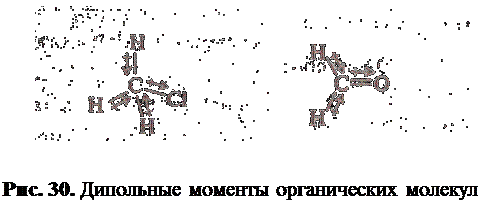 Чем больше дипольный момент молекулы, тем она более полярна (рис. 30).
Чем больше дипольный момент молекулы, тем она более полярна (рис. 30).
Дипольный момент связи не является величиной постоянной. Способность связи становиться более полярной под действием внешнего электрического поля называется поляризуемостью. Она определяется в основном поляризуемостью атомов, т.е. деформацией их электронных оболочек под действием электрического поля, создаваемого растворителем или соседними ионами. Деформация электронной оболочки атома приводит к передаче части электронной плотности другому атому и появлению на атомах эффективных зарядов.
Поляризуемость частиц зависит от их размера и числа электронов. Если сравнивать ионы с одинаковым зарядом и числом валентных электронов, то ионы большего размера поляризуюся легче. Это объясняется тем, что их электроны в меньшей степени взаимодействуют с положительно заряженным ядром и обладают большей подвижностью. Таким образом, чем меньше размер частицы и число её электронов, тем меньше её поляризуемость. Такие частицы называются «жесткими». Крупные частицы легко поляризуются и называются «мягкими» (табл. 4).
Таблица 4.«Жёсткие» и «мягкие» частицы
| Частицы | Жесткие | Увеличение «мягкости» | Мягкие | |||
| Атомы | Li | Na | K | Rb | Cs | Fr |
| Молекулы | HF | HOH | NH3 | HSH | HI | |
| Катионы | H+ | K+ | Ca2+ | Fe2+ | Cu2+ | Hg2+ |
| Анионы | F- | HO- | Cl- | Br- | I- | CN- |
Поляризуемость связи зависит от подвижности общих электронных пар. Сравним полярность и поляризуемость связей в молекулах галогеноводородов: дипольный момент связи H–F велик, а её поляризуемость мала (связь более полярна, но слабо поляризуема), дипольный момент связи H–I мал, а её поляризуемость велика (связь менее полярна, но хорошо поляризуема). Это объясняется тем, что атомный радиус йода больше, чем у фтора, внешние электроны находятся дальше от ядра и слабо им удерживаются, и, следовательно, легко смещаются под действием внешнего электрического поля. Увеличение поляризуемости связи приводит к возрастанию реакционной способности частиц. Так в водных растворах молекулы HF ведут себя как слабые электролиты, а молекулы HI — как сильные.В органических молекулах легче поляризуются те связи, у которых максимум электронной плотности расположен дальше от связываемых ядер: π-связь по поляризуемости значительно превосходит σ-связь.Характерными особенностями ковалентной связи являются её направленность и насыщаемость. Под насыщаемостью понимают свойство атомов образовывать строго определённое число ковалентных связей. Например, в молекуле водорода химическая связь осуществляется одной общей электронной парой. Принцип Паули запрещает использование одной и той же атомной орбитали дважды в образовании химической связи, поэтому присоединение третьего атома к молекуле Н2 исключается. Максимальное число ковалентных связей любого атома определяется количеством неспаренных электронов и числом орбиталей способных образовывать координативные связи (свободные орбитали или содержащие неподелённые электронные пары). Вследствие насыщаемости ковалентной связи молекулы имеют определённый химический состав.Химические связи, образованные более чем одной парой электронов называются кратными. Кратность связи (или порядок связи) между двумя атомами определяется числом пар электронов, участвующих в её образовании: F − F кратность = 1;C ═ C кратность = 2;N ≡ N кратность = 3.Направленность ковалентных связей определяется величиной валентных углов, т.е. углов между двумя связями, имеющими общий атом. В органических соединениях углы X—C—Y должны соответствовать состоянию гибридизации атома углерода. Если sp3- гибридизованный атом углерода соединён с четырьмя одинаковыми атомами или группами (например, в молекуле метана, тетрахлорметана, тетраметилметана), то образованные им связи располагаются строго под углом 109о28’. Однако в большинстве случаев валентные углы отличаются от идеальных значений. Так, в молекуле пропана угол С—С—С равен 112,5о, а в молекуле 2-бромпропана угол С—С—Br составляет 114,2о.Для атома углерода в sp2- или sp-гибридизации также наблюдаются отклонения от углов 120о и 180о соответственно, особенно в тех случаях, когда заместители имеют разную ЭО. Пространственные затруднения также влияют на величину валентного угла (рис. 31).
 |
Ваша оценка?






