- Бром: общая характеристика элемента
- История открытия
- Общие сведения о валентности брома
- Валентность брома в соединениях
- Электронная схема брома
- Степень окисления брома
- Ионы брома
- Примеры решения задач
- Нахождение брома в природе
- Физические и химические свойства брома
- Бромсодержащие кислоты
- Значение брома для организма человека
- Суточная потребность организма в броме
- Как сказывается недостаток брома на здоровье человека?
- Получение брома
- Применение брома и его соединений.
- Бром как оружие химической атаки
- Бром в современной медицине
- Пищевые источники
Бром: общая характеристика элемента
Как частица периодической системы, бром занимает ячейку под порядковым номером 35. Соответственно, в составе его ядра 35 протонов, а электронная оболочка вмещает такое же количество электронов. Конфигурация внешнего слоя: 4s2p5.
Располагается в VII группе, главной подгруппе, входит в состав галогенов — особой по свойствам группы химических элементов. Всего известно около 28 различных изотопных разновидностей данного атома. Массовые числа варьируются от 67 до 94. Устойчивых и стабильных, а также преобладающих по процентному содержанию в природе известно два:
- бром 79 — его 51%;
- бром 81 — его 49%.
Средняя атомная масса элемента равна 79,904 единицы. Степень окисления брома варьируется от -1 до +7. Проявляет сильные окислительные свойства, однако уступает в них хлору и фтору, превосходя йод.
История открытия
Открыт данный элемент был позже своих коллег по подгруппе. К тому моменту уже было известно о хлоре и йоде. Кто же совершил это открытие? Можно назвать сразу три имени, так как именно столько ученых практически одновременно сумели синтезировать новый элемент, оказавшийся впоследствии рассматриваемым атомом. Эти имена:
- Антуан Жером Балар.
- Карл Левиг.
- Юстус Либих.
Однако официальным «отцом» считается именно Балар, так как он первым не только получил и описал, но и отправил на научную конференцию химиков новое вещество, представляющее собой неизведанный элемент.
Антуан Балар занимался исследованием состава морской соли. Проводя над ней многочисленные химические опыты, он в один из дней пропускал через раствор хлор и увидел, что образуется какое-то желтое соединение. Приняв это за продукт взаимодействия хлора и йода в растворе, он стал дальше исследовать полученный продукт. Подверг следующим обработкам:
- воздействовал эфиром;
- вымочил в гидроксиде калия;
- обработал пиролюзитом;
- выдержал в сернокислой среде.
В результате он получил летучую буровато-красную жидкость с неприятным запахом. Это и был бром. Затем он провел тщательное исследование физических и химических характеристик этого вещества. После отправил доклад о нем, описал свойства брома. Название, которое Балар дал элементу, было мурид, однако оно не прижилось.
Сегодняшнее общепринятое имя этого атома бром, что в переводе с латыни означает «вонючий», «зловонный». Это вполне подтверждается свойствами его простого вещества. Год открытия элемента — 1825.

Общие сведения о валентности брома
Бром расположен в четвертом периоде VII группы главной (А) подгруппы Периодической таблицы. Неметалл. Обозначение – Br. Порядковый номер – 35.
В виде простого вещества бром представляет собой жидкость красно-бурого цвета, обладающую резким неприятным запахом. Ядовит. Плотность 3,19 г/см3 (при t0 = 0oC). При кипении (t0 = 58,6oC) бром из жидкого состояния переходит в газообразное – образует буро-коричневый пар.
Молекула брома двухатомна Br2.
Валентность брома в соединениях
Бром – тридцать пятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в четвертом периоде в VIIA группе. В ядре атома брома содержится 35 протонов и 45 нейтронов (массовое число равно 80). В атоме брома есть четыре энергетических уровня, на которых находятся 35 электронов (рис. 1).
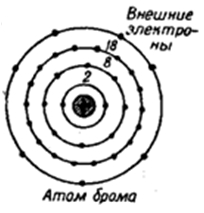
Рис. 1. Строение атома брома.
Электронная формула атома брома в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p5.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
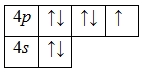
Наличие одного неспаренного электрона свидетельствует о том, что бром способен проявлять валентность I (низшая валентность) в своих соединениях (HBr, HBrO).
Для атома брома характерно наличие нескольких возбужденных состояний из-за того, что орбитали 4d-подуровня являются вакантными (на четвертом энергетическом слое помимо 4s- и 4p-подуровней есть еще и 4d-подуровень). Сначала распариваются электроны 4p -подуровня и занимают свободные d-орбитали, а после – электроны 4s-подуровня:
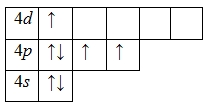
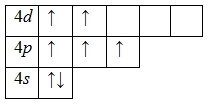
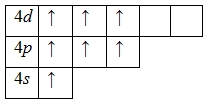
Наличие трех, пяти и семи неспаренных электронов в возбужденном состоянии свидетельствует о том, что бром проявляет в своих соединениях валентности III (AuBr3, HBrO2), V (HBrO3) и VII (HBrO4) (высшая валентность).
Электронная схема брома
Br: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 → Br-: 1s22s22p63s23p64s23d104p6
Одинаковую электронную конфигурацию имеют ион брома -1 и -3As, -2Se, Kr, +1Rb, +2Sr, +3Y, +4Zr, +7Tc
Порядок заполнения оболочек атома брома (Br-) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Бром имеет 35 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
Степень окисления брома
Атомы брома в соединениях имеют степени окисления 7, 5, 4, 3, 1, 0, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Степень окисления иона Br- = -1
Ионы брома
7+Br 5+Br 4+Br 3+Br 1+Br 0Br Br 1-
Примеры решения задач
ПРИМЕР 1
| Задание | Относительная плотность паров брома по воздуху равна 5,37. Какова молекулярная (истинная) формула брома? |
| Решение | Молярная масса брома будет рассчитываться по формуле: M = D × 29; M = 5,37 × 29 = 155,73 г/моль. Относительная атомная масса брома равна 79,904 а.е.м. Значит, в молекуле брома имеется: x=M/Ar = 155,73/79,904 = 2 атома брома. Молекулярная (истинная) формула брома имеет вид Br2. |
| Ответ | Br2 |
ПРИМЕР 2
| Задание | Алкен массой 4,2 г может максимально присоединить 16,0 г брома. Установите формулу алкена. |
| Решение | Общая формула алкенов имеет вид CnH2n. Молярная масса равна 14n.Составим уравнение реакции присоединения брома алкеном: CnH2n + Br2 = CnH2nBr2. Согласно уравнению реакции n(Br2) :n (CnH2n) = 1:1, т.е. n(Br2) = n (CnH2n). Найдем число моль брома (молярная масса – 160 г/моль): n = m / M; n(Br2) = m (Br2) / M (Br2); n (Br2) = 16 / 160 = 0,1 моль. Тогда, n (CnH2n) =0,1 моль. Определим молярную массу алкена: M (CnH2n) = m (CnH2n) / n (CnH2n); M (CnH2n) = 4,2/ 0,1 = 42 г/моль. 42 = 14n; n=3. Формула алкена имеет вид Cn3H6. |
| Ответ | Формула алкена имеет вид Cn3H6. |
Нахождение брома в природе
Бром – широко распространённый химический элемент, во внешней среде встречается практически везде. Особенно много брома находится в солёной воде – морей и озёр, там он имеется в виде бромида калия, бромида натрия и бромида магния. Наибольшее количество брома образуется при испарении морской воды, есть он и в некоторых горных породах, а также в растениях.
В организме человека находятся до 300 мг брома, в основном в щитовидной железе, так же бром содержит кровь, почки и гипофиз, мышцы и костная ткань.
Физические и химические свойства брома
Бром обычно представляет собой едкую тяжёлую жидкость, имеет красно-бурый цвет и резкий, очень неприятный (зловонный) запах. Является единственным из неметаллов, при комнатной температуре находящийся в жидком состоянии.
Бром (а также – пары брома)– токсичное и ядовитое вещество, при работе с ним необходимо применять средства химической защиты, потому что при попадании на кожу и слизистые человека бром образует ожоги.
Состав природного брома – два стабильных изотопа (79Br и 81Br), молекула брома состоит из двух атомов и имеет химическую формулу Br2.
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.
Значение брома для организма человека
Чистый бром – высокотоксичное вещество! Только 3 грамма элементарного брома при попадании внутрь вызывают отравление, а 35 граммов смертельны. Соприкосновение с жидким бромом чревато болезненным, плохозаживляемым ожогом. 0,001 % брома в воздухе вызывают кашель, удушье, головокружение, кровотечение из носа, а превышение этой цифры грозит дыхательными спазмами и летальным исходом. Однако, несмотря на ядовитость, значение брома для организма человека трудно приуменьшить. Он является микроэлементом, содержащимся в наших органах и тканях: мозге, крови, печени ипочках, в щитовидной железе, мышечных тканях и костях… В малых количествах он необходим нам!

Бром оказывает влияние на центральную нервную систему. Аккумулируясь в коре головного мозга, он регулирует деятельность нейронов, отвечая за баланс между реакциями возбуждения и торможения. При необходимости он посредством мембранных ферментов усиливает торможение, чем и обусловлено его успокаивающее действие.
Важен этот микроэлемент и для эндокринной системы, так как он выступает своеобразной альтернативой йода и уменьшает потребность щитовидной железы в йоде, предупреждая её разрастание – возникновение эндемического зоба.
Роль брома в работе желудочно-кишечного тракта обусловлена его активирующим действием на пищеварительные ферменты:
- пепсин (необходим для расщепления белков);
- амилазу (расщепляет углеводы);
- липазу (растворяет и сортирует жиры при переваривании).
Вопрос о влиянии брома на половую активность мужчин окутан мифами. В частности, о том, что раньше заключённым в тюрьмах, пациентам психиатрических отделений больниц и солдатам в армии в пищу добавлялся данный минерал в целях ослабления эректильной функции. Долгое время полагалось, что бром, оказывая общее успокоительное действие на организм, угнетает и сексуальную сферу. Однако позднейшие исследования доказали совсем противоположный эффект от приёма бромистых препаратов, способствующих стабилизации половой системы у мужчин, увеличению семенной жидкости и количества сперматозоидов в ней.
Бром выводится из организма с мочой и при потоотделении. Так что его поступление извне через продукты питания (а при необходимости – в фармакологических препаратах) необходимо. Однако выведение его – процесс длительный, поэтому возможно повышение его концентрации в органах и тканях, что весьма опасно для здоровья.
Суточная потребность организма в броме
Потребность здорового организма в броме – не более 0,8-1 г.
Как сказывается недостаток брома на здоровье человека?
Недостаток брома может вызвать ряд серьёзных функциональных нарушений. В детском и подростковом возрасте его дефицит может привести к замедлению роста, а для взрослых людей чреват уменьшением продолжительности жизни. Проблемы с засыпанием, неврастенические и истерические проявления, анемия, вызванная падением уровня гемоглобина, увеличение риска самопроизвольного выкидыша у беременных женщин, ослабление половых функций, проблемы с пищеварением, обусловленные снижением кислотности, – всё это может быть следствием недостатка данного минерала. Причинами этого состояния являются метаболические отклонения или злоупотребление мочегонными средствами, способствующими выведению брома из организма. Диагностировать нехватку брома и назначить лечение должен обязательно специалист, а заниматься самолечением без консультаций с врачом в данном случае категорически не рекомендуется.
Получение брома
Промышленное производство брома началось в 1865 на базе Страссфуртского соляного месторождения в Германии, двумя годами позже бром стали добывать в США, в штате Вирджиния. В 1924 на борту судна «Этила» была продемонстрирована возможность добычи брома из морской воды, а в 1934 организовано промышленное производство, основанное на этом методе. В России первый бромный завод был построен в 1917 на соляном озере Сакское.
Все промышленные способы получения брома из соляных растворов основаны на его вытеснении хлором из бромидов:
MgBr2 + Cl2 = MgCl2 + Br2
При получении брома методом выдувания исходное сырье (рапу соляных озер, попутные воды нефтяных скважин, морскую воду) подкисляют серной кислотой до pH»3,5 и обрабатывают избыточным количеством хлора. Затем рассол, содержащий растворенный бром, подают в верхнюю часть колонны, заполненной небольшими керамическими кольцами. Раствор стекает по кольцам, а навстречу ему продувают мощную струю воздуха, при этом бром переходит в газовую фазу. Бромовоздушную смесь пропускают через раствор карбоната натрия:
3Na2CO3 + 3Br2 = 5NaBr + NaBrO3 + 3CO2
Для выделения брома из полученной смеси бромида и бромата натрия, ее подкисляют серной кислотой:
5NaBr + NaBrO3 + 3H2SO4 = 3Na2SO4 + 3Br2 + 3H2O
Если содержание бромидов в исходном сырье достаточно велико, то вместо воздуха экономически выгоднее использовать водяной пар.
Другие предложенные способы извлечения брома из хлорированного рассола: экстракция углеводородами или адсорбция ионообменными смолами – не получили широкого распространения.

Часть используемых в промышленности растворов бромидов (в США до 35%) отправляют на повторную переработку с целью получения дополнительных количеств брома.
Мировое производство брома (по данным на 2003) составило около 550 тыс. тонн в год, большая часть его производится в США (39,4%), Израиле (37,6%), и Китае (7,7%). Динамика производства брома в различных странах мира приведена в таблице 1.
Таблица 1. Динамика мирового производства брома
| Табл. 1. ДИНАМИКА МИРОВОГО ПРОИЗВОДСТВА БРОМА (в тыс. тонн). | |||||
| Страна | 1999 | 2000 | 2001 | 2002 | 2003 |
| США | 239 | 228 | 212 | 222 | 216 |
| Израиль | 181 | 210 | 206 | 206 | 206 |
| Китай | 42 | 42 | 40 | 42 | 42 |
| Великобритания | 55 | 32 | 35 | 35 | 35 |
| Иордания | – | – | – | 5 | 20 |
| Япония | 20 | 20 | 20 | 20 | 20 |
| Украина | 3 | 3 | 3 | 3 | 3 |
| Азербайджан | 2 | 2 | 2 | 2 | 2 |
| Франция | 1,95 | 2 | 2 | 2 | 2 |
| Индия | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 |
| Германия | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Италия | 0,3 | 0,3 | 0,3 | 0,3 | 0,3 |
| Туркменистан | 0,15 | 0,15 | 0,15 | 0,15 | 0,15 |
| Испания | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 |
| Всего в мире | 547 | 542 | 523 | 540 | 548 |
Цена элементного брома колеблется от 700 до 1000 долл. за тонну. Годовая потребность России в броме оценивается в 20–25 тыс. тонн, она удовлетворяется, в основном, за счет импорта из США и Израиля.
В лаборатории бром можно получить взаимодействием бромидов с подходящим окислителем, например перманганатом калия или диоксидом марганца, в кислой среде.
MnO2 + 2H2SO4 + 2NaBr = Br2 + MnSO4 + Na2SO4
Выделившийся бром отделяют экстракцией неполярными растворителями или перегонкой с водяным паром.
Применение брома и его соединений.
Первым известным применением соединений брома было производство пурпурного красителя. Его добывали еще во втором тысячелетии до нашей эры из моллюсков вида «мурекс», накапливающих бром из морской воды. Процесс извлечения красителя был очень трудоемок (из 8000 моллюсков можно получить всего 1 грамм пурпура) и позволить себе носить окрашенную им одежду могли только очень богатые люди. В древнем Риме носить ее могли только представители высшей власти, поэтому он получил название «королевский пурпур». Структуру действующего начала этого красителя установили только во второй половине 19 в., им оказалось соединение брома – 6,6’– диброминдиго. Бромпроизводные индиго, синтезируемые искусственно, используются для окрашивания тканей (в основном, хлопковых) и сейчас.
В 19 в. главными областями использования соединений брома были фотография и медицина.
Бромид серебра AgBr стал применяться как светочувствительный материал около 1840. Современные фотоматериалы на основе AgBr позволяют делать снимки с выдержкой 10–7 секунды. Для изготовления фотопленки на основе бромида серебра, эта соль синтезируется в водном растворе желатина, при этом выпавшие кристаллики AgBr равномерно распределяются по всему объему раствора. После застывания желатина образуется тонкодисперсная суспензия, которую тонким слоем (толщиной от 2 до 20 мкм) равномерно наносят на поверхность носителя – прозрачной пленки, изготовленной из ацетата целлюлозы. В каждом квадратном сантиметре полученного слоя содержится несколько сот миллионов зерен бромида серебра, окруженных желатиновой пленкой. При попадании света на такую фотопленку происходит фотолитическое разложение AgBr:
AgBr + hv = Ag + Br
Протеканию в фотоэмульсии обратного процесса – окисления серебра бромом, препятствует желатина. Фотолиз приводит к образованию в микрокристаллах AgBr групп атомов серебра с размерами 10–7–10–8 см, так называемых центров скрытого изображения. Для получения видимого изображения бромид серебра на засвеченных участках восстанавливают до металлического серебра. Центры скрытого изображения катализируют (ускоряют) реакцию восстановления и позволяют провести ее, практически не затронув неосвещенных кристалликов AgBr. После растворения оставшегося бромида серебра на фотопленке получается черно-белое изображение (негатив), устойчивое к действию света. Для создания позитивного изображения нужно повторить процесс, освещая (обычно) фотобумагу через пленку, на которой с негативным изображением.
Соли брома оказались очень эффективными лекарственными средствами для лечения многих нервных болезней. Знаменитый русский физиолог И.П.Павлов сказал: «Человечество должно быть счастливо тем, что располагает таким драгоценным для нервной системы препаратом, как бром». Использование KBr в медицине в качестве седативного (успокоительного) и противосудорожного средства при лечении эпилепсии началось в 1857. В то время водные растворы бромида калия и натрия были известны под общим названием «бром». В течение долгого времени механизм действия препаратов брома оставался неизвестным, считалось, что бромиды уменьшают возбудимость, действуя аналогично снотворным. Лишь в 1910 один из учеников Павлова П.М.Никифоровский экспериментально показал, что бромиды усиливают процессы торможения в центральной нервной системе. Сейчас бромиды натрия и калия практически вышли из употребления при лечении нервных заболеваний. Они были вытеснены более эффективными броморганическими препаратами.

В начале 20 в. открылась новая область применения брома. С распространением автомобилей появилась нужда в больших количествах дешевого бензина, вместе с тем существующая в то время нефтяная промышленность не могла производить требуемые объемы высокооктанового горючего. Для улучшения качества топлива – уменьшения его способности к детонации в двигателе – в 1921 американский инженер Томас Мидгли (Thomas Midgley) предложил вводить в бензин дополнительный компонент – тетраэтилсвинец (Pb(C2H5)4, ТЭС). Эта добавка оказалась очень эффективной, но при ее использовании возникла новая проблема – отложения свинца в двигателях. Чтобы избежать их образования, ТЭС растворяют в бромуглеводородах – 1,2 -дибромэтане (BrCH2CH2Br) и этилбромиде (C2H5Br), полученная смесь получила название «этиловая жидкость». Механизм ее действия заключается в том, что при совместном сгорании бромуглеводородов и ТЭС образуются летучие бромиды свинца, которые выносятся из двигателя вместе с выхлопными газами. В середине прошлого века на производство этиловой жидкости расходовалась большая часть производимого брома – 75% в 1963. Сейчас использование этиловой жидкости не соответствует современным требованиям экологической безопасности и ее мировое производство сокращается: в России, например, доля этилированного (содержащего этиловую жидкость) бензина в общем объеме автомобильного топлива составляла в 1995 более 50%, а в 2002 – 0,4%. В России использование ТЭС запрещено с 2003, а в некоторых регионах– еще раньше (в Москве – с 1993).
Теперь основной областью использования брома является производство антипиренов (от 40% мирового потребления брома). Антипирены – вещества, защищающие материалы органического происхождения от воспламенения. Их используют для пропитки тканей, изделий из древесины и пластмасс, производства негорючих красок. В качестве антипиренов применяются, в основном, ароматические бромпроизводные: дибромстирол, тетрабромфталевый ангидрид, декабромдифенилоксид, 2,4,6-трибромфенол и другие. Бромхлорметан используется в качестве наполнителя огнетушителей, предназначенных для тушения электропроводки.
Значительная часть брома (в США – 24%) в форме бромидов кальция, натрия и цинка расходуется для изготовления буровых растворов, которые закачивают в скважины для увеличения объема добытой нефти.
До 12% брома идет на синтез пестицидов и инсектицидов, используемых в сельском хозяйстве и для защиты деревянных изделий (метилбромид).
Элементный бром и его соединения применяются в процессах водоочистки и водоподготовки. Бром иногда используют для мягкой дезинфекции воды в бассейнах при повышенной чувствительности к хлору. На эти цели расходуется 7% производимого брома.
Около 17% брома расходуется на производство фотографических материалов, фармацевтических препаратов и высококачественной резины (бромбутилкаучука).
Органические соединения брома применяют для ингаляционного наркоза (галотан – 1,1,1-трифтор-2-хлор-2-бромэтан, CF3CHBrCl), в качестве обезболивающих, успокоительных, антигистаминных и антибактериальных препаратов, при лечении язвенных болезней, эпилепсии, сердечно-сосудистых заболеваний. Изотоп брома с атомной массой 82 находит применение в медицине при лечении опухолей и при изучении поведения бромсодержащих препаратов в организме.
Бромбутилкаучук получают в промышленности при неполном бромировании бутилкаучука – сополимера 97–98% изобутилена CH2=C(CH3)2 и ne 2–3% изопрена CH2=C(CH3)CH=CH2. В этом процессе происходит бромирование только изопреновых звеньев макромолекулы каучука:
–CH2 –C(CH3)=CH–CH2– + Br2 = –CH2–CBr(CH3) –CHBr–CH2–
Введение брома в бутилкаучук существенно повышает скорость его вулканизации. Бромбутилкаучук не имеет запаха, не выделяет вредных веществ при хранении и переработке, он отличается высокой степенью совулканизации с ненасыщенными каучуками и лучшей, чем у бутилкаучука, адгезией к другим полимерам. Галогенированные бутилкаучуки используются для герметизации резиновых изделий из других полимеров (например, в производстве автомобильных шин), для изготовления теплостойких транспортных лент с высоким сопротивлением истиранию, резиновых пробок, химически стойких обкладок емкостей.
Бром как оружие химической атаки
Любое лекарство в большой дозе может быть ядом. Это в немалой степени относится и к брому. Вдыхание паров этого соединения может быть очень опасным не только для здоровья, но и для жизни. В начале первой Мировой войны французские войска использовали этилбромацетат против немецкий войск. Симптомы отравления бромом были следующими: утрата различных жизненно-важных рефлексов, включая глотательный и кашлевой, делирий, дрожь в руках, на коже появлялась специфическая сыпь — бромодерма.
К слову говоря, эти высыпания могут возникнуть даже у детей, мать которых принимает бром в качестве успокоительного и при этом кормит малыша грудью. Ведь доза брома, безопасная для взрослой женщины, является для младенца токсической, и у него могут возникнуть все симптомы отравления.
Бром в современной медицине
В качестве седативного средства бром сегодня никто не применяет. Учитывая наличие серьезных побочных эффектов, высокий риск передозировки, предпочтения отдают более безопасным препаратам. Однако различные соединения брома нашли активное применение в медицине.
Пищевые источники
Бром содержится в следующих продуктах питания:
- пшенице;
- миндале;
- арахисе;
- фасоли;
- бобах;
- макаронных изделиях;
- ячневой крупе;
- поваренной соли;
- ржаном хлебе;
- чечевице;
- сметане;
- молоке;
- треске;
- грецких орехах;
- фундуке;
- креветках;
- водорослях (морской капусте).
Максимальные дозировки брома (до 250 микрограмм на 100 грамм продукта) присутствуют в морепродуктах и грибах, при этом в бобовых, орехах, злаках количество соединения снижается до 80 микрограмм. В молоке, мясе, субпродуктах уровень минерала едва достигает 5 – 10 микрограмм. В растениях больше всего брома сосредоточено в листьях, меньше – в корнях.
При термической обработке продуктов, содержащих микроэлемент, потери полезного соединения достигают 70%.
- https://FB.ru/article/184438/minimalnaya-i-maksimalnaya-stepen-okisleniya-broma-himicheskie-svoystva-broma
- http://ru.solverbook.com/spravochnik/ximiya/valentnost/valentnost-broma/
- https://k-tree.ru/tools/chemistry/periodic.php?element=Br&oxidation=-1
- https://calorizator.ru/element/br
- https://chem.ru/brom.html
- https://leveton.su/brom/
- https://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/BROM.html
- https://MedAboutMe.ru/articles/brom_est_li_emu_mesto_v_sovremennoy_meditsine/
- https://FoodandHealth.ru/mineraly/produkty-pitaniya-bogatye-bromom/
Ваша оценка?