Большинство начальных химических понятий по определению содержат признаки, характеризующие свойства веществ с количественной стороны. Вследствие этого они могут быть выражены и описаны с помощью физических величин. Важнейшими физическими величинами, используемыми в химии, являются количество вещества, масса, объем и другие, производные от них.
Количество вещества п — физическая величина, определяемая числом элементарных объектов (структурных единиц), из которых это вещество состоит. Под элементарными объектами понимают атомы, молекулы, ионы, электроны, любые условные части или фрагменты молекулы.
За единицу количества вещества принят моль, определяемый как количество вещества системы, содержащей столько же структурных единиц, сколько атомов содержится в 0,012 кг углерода 12С. Эта величина является фундаментальной физической константой, называется постоянной Авогадро и обозначается NA:
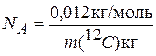 (1.1)
(1.1)
Численное значение NA может быть установлено различными способами и составляет 6,02*1023 моль-1. По определению, 1 моль любого вещества при любых условиях содержит одинаковое число структурных единиц. Если вещество количеством 1 моль содержит постоянное и известное число элементарных объектов N, численно равное NA, то для вещества количеством п моль число элементарных объектов может быть определено так
N = n*NA. (1.2)
Для измерения массы в химии используются абсолютная и относительная шкалы. Важнейшим является также понятие «масса молярная».
В абсолютной шкале измеряют массу объекта любой величины от атома до порции вещества (единица измерения в СИ — кг).
Относительную шкалу используют преимущественно в химии и физике для выражения масс атомов и молекул. Она существует со времен Дальтона, причем за 200 лет единицы массы (эталоны) менялись несколько раз. В настоящее время в относительной шкале за единицу массы принята 1/12 массы нуклида углерода 12С. Эта величина называется постоянной атомной массой и обозначается тu. Она является фундаментальной физической константой, ее округленное численное значение в абсолютной шкале масс составляет 1,66*10-27 кг.
Относительная атомная масса любого химического элемента (Аr) — это отношение массы его атома тa (с учетом изотопного состава) к тu или 1/12 массы углерода |2С. По аналогии с Аr, относительной молекулярной массой ( Mr ) вещества называется отношение массы молекулы mf к тu или 1/12 массы углерода |2С:
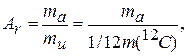 (1.3)
(1.3)
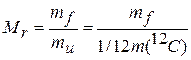 . (1.4)
. (1.4)
Численные значения Аr указаны в периодической системе элементов Д. И. Менделеева под символом каждого элемента как отношение масс, выраженных в одной шкале. Аr и Мr не имеют единиц величины. Относительная атомная масса рассчитывается как сумма масс всех атомов, составляющих молекулу (для веществ немолекулярного строения говорят о формульной массе).
Молярная масса (М) — важнейшая характеристика вещества на уровне порции, такая же, как Аr и Мr на уровне атомов и молекул. По определению, это масса вещества количеством 1 моль и обозначается М, единица измерения в СИ — кг/моль. Молярная масса связывает две физические величины: абсолютную массу т и количество вещества п и показывает, какую массу имеет порция вещества химическим количеством п.
Масса определенного количества вещества равна произведению массы элементарного объекта то на число объектов N, т. е.
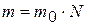 . (1.5)
. (1.5)
Для любого вещества молярная масса (масса 1 моль) определяется как произведение массы его элементарного объекта т0 на число объектов, т. е. на NA:
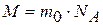 . (1.6)
. (1.6)
Из двух последних выражений следует:
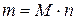 (1.7)
(1.7)
т. е. массу вещества легко определить, зная его количество.
В химии используются две шкалы масс. Решение, практически, любой задачи начинается с определения масс в относительной шкале в соответствии с Периодической системой элементов Д. И. Менделеева, и по их значениям производят расчеты в абсолютной шкале. Переход между шкалой относительной и абсолютной возможен потому, что численные значения масс совпадают. Масса 1 атома 12С в относительной шкале будет равна
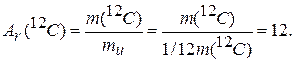 (1.8)
(1.8)
При выборе единицы количества вещества было принято во внимание число 12, выражающее относительную атомную массу углерода 12С, и в качестве единицы количества вещества установлено содержание атомов в 12 г (точно) углерода 12С. Это и предопределяет совпадение масс в разных шкалах. Итак, масса 1 атома 12С в относительной шкале -12 (Аr = 12), масса 1 моль 12С в абсолютной шкале -12 г (М = 12 г/моль).
Это выводится математически. Выразим массу молекулы т некоторого вещества через значения Мr и М. Тогда масса, выраженная через относительную молекулярную массу, будет иметь вид:
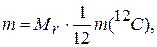 (1.9)
(1.9)
а выраженная через молярную массу — т = 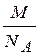 . С учетом
. С учетом 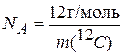 связь между атомной единицей массы и молярной массой можно представить в виде
связь между атомной единицей массы и молярной массой можно представить в виде
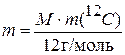 . (1.10)
. (1.10)
Приравняв значения масс, получим:
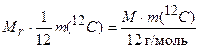 (1.11)
(1.11)
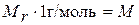 .
.
Таким образом, определив по периодической системе элементов численное значение массы структурной единицы вещества (атома или молекулы) в относительной шкале, мы находим массу 1 моль этого вещества в граммах, т. е. переходим в абсолютную шкалу.
В относительной шкале соотношения установлены между массами структурных единиц на уровне атома, молекулы. Для двух веществ, взятых в равных количествах (равных по числу структурных единиц), отношение между их массами в абсолютной шкале будет такое же, как между массами в относительной шкале, т. е. для веществ 1 и 2 выполняется равенство
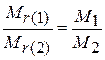 (1.12)
(1.12)
Объем — физическая величина, особенно существенная для характеристики веществ в газообразном состоянии, обозначается V, единица измерения в СИ — м3.
В расчетных задачах широко используется величина, связывающая объем с количеством вещества, — молярный объем Vm. Это объем газа или паров вещества, взятого в количестве 1 моль при р1Т= const, т.е.
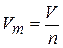 . (1.13)
. (1.13)
При нормальных условиях (н. у.) молярный объем газов принимается равным Vm = 22,4*10-3 м3/моль.
Итак, рассмотренные физические величины и константы Аr, Мr, m, n, M, V, Vm, N, NA связаны между собой определенными количественными отношениями: численные значения Мr и М совпадают, т. е. Мr*1 г/моль = М.
Эти определяющие уравнения и производные от них служат основой для расчетов.
Ваша оценка?