- Что собой представляет марганец?
- История открытия
- Физические свойства
- Химические свойства
- Атомная и молекулярная масса марганца
- Молекула и атом марганца
- Изотопы
- Общие сведения о валентности марганца
- Валентность марганца в соединениях
- Природное распространение марганца
- Химические свойства марганца
- Марганец в флоре и фауне
- Применение в промышленности
- Определение методами химического анализа
- Интересные сведения об элементе
- Марганец — суточная потребность
- Применение марганца в медицине
- Избыток марганца
Что собой представляет марганец?
Марганец — элемент, очень интересный с химической точки зрения. Он входит в состав многих соединений, известных как сильные окислители. В организме он тоже играет роль одного из ведущих минералов, отвечающих за окислительно-восстановительные процессы. Марганца в составе органов и тканей всего около 10-30 г. Большая часть элемента находится в поджелудочной железе, почках, костной ткани, сердце, печени, некоторых структурах мозга.
История открытия
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от немецкого Manganerz — марганцевая руда).
Физические свойства
Некоторые свойства приведены в таблице. Другие свойства марганца:
- Работа выхода электрона: 4,1 эВ
- Коэффициент теплового расширения: 0,000022 K−1 (при 0 °C)
- Электропроводность: 0,00695⋅106 Ом−1·см−1
- Теплопроводность: 0,0782 Вт/(см·K)
- Энтальпия атомизации: 280,3 кДж/моль при 25 °C
- Энтальпия плавления: 14,64 кДж/моль
- Энтальпия испарения: 219,7 кДж/моль
- Твёрдость:
- по шкале Бринелля: Мн/м²
- по шкале Мооса: 4
- Давление паров: 121 Па при 1244 °C
- Молярный объём: 7,35 см³/моль
Химические свойства
Стандартный окислительно-восстановительные потенциалы по отношению к водородному электроду ОкисленнаяформаВосстановленнаяформаСредаE0, В
| Mn2+ | Mn | H+ | −1,186 |
| Mn3+ | Mn2+ | H+ | +1,51 |
| MnO2 | Mn3+ | H+ | +0,95 |
| MnO2 | Mn2+ | H+ | +1,23 |
| MnO2 | Mn(OH)2 | OH− | −0,05 |
| MnO42− | MnO2 | H+ | +2,26 |
| MnO42− | MnO2 | OH− | +0,62 |
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |
Диаграмма Пурбе для марганца
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
Mn + O2 ⟶ MnO2
Марганец при нагревании разлагает воду, вытесняя водород:
Mn + 2H2O →∘t Mn(OH)2 + H2↑
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
С соляной и серной кислотами реагирует по уравнению
Mn + 2H+ ⟶ Mn2+ + H2↑
С концентрированной серной кислотой реакция идёт по уравнению
Mn + 2H2SO4 ⟶ MnSO4 + SO2↑ + 2H2O
С разбавленной азотной кислотой реакция идёт по уравнению
3Mn + 8HNO3 ⟶ 3Mn(NO3)2 + 2NO↑ + 4H2O
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях — жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца IV (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
2MnO2 + 4KOH + O2 ⟶ 2K2MnO4 + 2H2O
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция
3K2MnO4 + 3H2SO4 ⟶ 3K2SO4 + 2HMnO4 + MnO(OH)2↓ + H2O
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия)
2KMnO4 →∘t K2MnO4 + MnO2 + O2
Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
2MnSO4 + 5PbO2 + 6HNO3 ⟶ 2HMnO4 + 2PbSO4 + 3Pb(NO3)2 + 2H2O
Эта реакция используется для качественного определения Mn2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа». В нейтральных или кислых водных растворах ион Mn2+ образует окрашенный в бледно-розовый цвет аквакомплекс [Mn(H2O)6]2+.
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основный характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
MnO2 + 4HCl ⟶ MnCl2 + Cl2↑ + 2H2O
Нулевая степень окисления у марганца проявляется в соединениях с σ-донорными и π-акцепторными лигандами. Так, для марганца и известен карбонил состава Mn2(CO)10.
Известны и другие соединения марганца с σ-донорными и π-акцепторными лигандами (PF3, NO, N2, P(C5H5)3).
Атомная и молекулярная масса марганца
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии марганец существует в виде одноатомных молекул Mn, значения его атомной и молекулярной масс совпадают. Они равны 54,9380.
Молекула и атом марганца
В свободном состоянии марганец существует в виде одноатомных молекул Mn. Приведем некоторые свойства, характеризующие атом и молекулу марганца:
| Энергия ионизации атома, эВ | 7,43 |
| Относительная электроотрицательность | 1,55 |
| Радиус атома, нм | 0,127 |
Изотопы
Марганец является моноизотопным элементом — в природе существует только один устойчивый изотоп 55Mn. Все другие изотопы марганца нестабильны и радиоактивны, они получены искусственно. Известны 25 радиоактивных изотопов марганца, имеющие массовое число А в диапазоне от 44 до 70. Наиболее стабильными из них являются 53Mn (период полураспада T1/2 = 3,7 млн лет), 54Mn (T1/2 = 312,3 суток) и 52Mn (T1/2 = 5,591 суток). Преобладающим каналом распада лёгких изотопов марганца (А < 55) является электронный захват (и иногда конкурирующий с ним позитронный распад) в соответствующие изотопы хрома. У тяжёлых изотопов (А > 55) основным каналом распада является β−-распад в соответствующие изотопы железа. Известны также 7 изомеров (метастабильных возбуждённых состояний) с периодами полураспада более 100 нс.
Общие сведения о валентности марганца
Марганец расположен в четвертом периоде VII группы побочной (B) подгруппы Периодической таблицы. Металл. Обозначение – Mn. Порядковый номер – 25.
Марганец – серебристо-белый металл. Плотность – 7,44 г/см3. Температуры плавления и кипения равны 1245oС и 2080oС, соответственно. Известны четыре кристаллические модификации марганца, каждая из которых устойчива в определенном интервале температур. Так, например, при температуре ниже 707oС устойчив α-марганец, имеющий сложную структуру – в его элементарную ячейку входят 58 атомов.
Валентность марганца в соединениях
Марганец находится в четвертом периоде в VIIB группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 25. В ядре атома марганца содержится 25 протонов и 31 нейтрон (массовое число равно 56). В атоме марганца есть четыре энергетических уровня, на которых находятся 25 электронов (рис. 1).
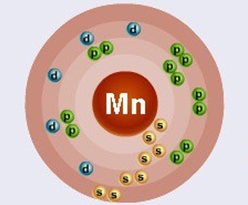
Рис. 1. Строения атома марганца.
Электронная формула атома марганца в основном состоянии имеет следующий вид:
1s22s22p63s23p63d54s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
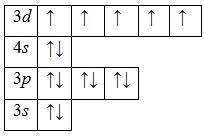
Наличие пяти неспаренных электронов свидетельствует о том, что марганец в своих соединениях может проявлять валентность V, однако эти вещества неустойчивы и быстро разлагаются.
Атом марганца способен переходить в возбужденное состояние: электроны 4s-подуровня распариваются и один из них занимает вакантную орбиталь 4p-подуровня:
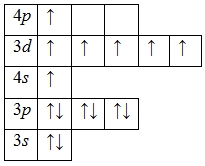
Наличие семи неспаренных электронов свидетельствует о том, что марганец в своих соединениях также может проявлять валентность VII (высшая) (MnVII2O7, MnVIIO3F).
Известно, что для марганца также характерны валентности II (MnIIO, MnII(OH)2, MnIICl2, MnIIS, MnIICO3, MnII3(PO4)2), IV (MnIVO2) и VI(MnVIF6, MnVIOF4, MnVIO3).
Природное распространение марганца
В природе химический элемент марганец малораспространен, в земной коре его содержится всего 0,1%, в вулканической лаве 0,06–0,2%, металл на поверхности в рассеянном состоянии, имеет форму Мn2+. На поверхности земли под воздействием кислорода быстро образуются окислы марганца, имеют распространение минералы Мn3+ и Мn4+, в биосфере металл малоподвижен в окислительной среде. Марганец – химический элемент, активно мигрирует при наличии восстановительных условий, металл очень подвижен в кислых природных водоемах тундры и лесных ландшафтах, где преобладает окислительная среда. По этой причине культурные растения имеют избыточное содержание металла, в почвах образуются железомарганцевые конкреции, болотные и озерные низкопроцентные руды.
В регионах с сухим климатом преобладает щелочная окислительная среда, что ограничивает подвижность металла. В культурных растениях ощущается недостаток марганца, сельхозпроизводство не может обходиться без использования специальных комплексных микродобавок. В реках химический элемент малораспространен, но суммарный вынос может достигать больших величин. Особенно много марганца имеется в прибрежных зонах в виде естественных осадков. На дне океанов встречаются большие залежи металла, которые образовались в давние геологические периоды, когда дно было сушей.
Химические свойства марганца
Марганец относится к категории активных металлов, при повышенных температурах активно вступает в реакции с неметаллами: азотом, кислородом, серой, фосфором и другими. В результате образуются разновалентные окислы марганца. При комнатной температуре марганец химический элемент малоактивен, при растворении в кислотах образует двухвалентные соли. При нагреве в вакууме до высоких температур химический элемент способен испаряться даже из устойчивых сплавов. Соединения марганца во многом схожи с соединениями железа, кобальта и никеля, находящихся в такой же степени окисления.
Наблюдается большое сходство марганца с хромом, подгруппа металла также имеет повышенную устойчивость при высших степенях окисления при увеличении порядкового номера элемента. Перенаты являются менее сильными окислителями, чем перманганаты.
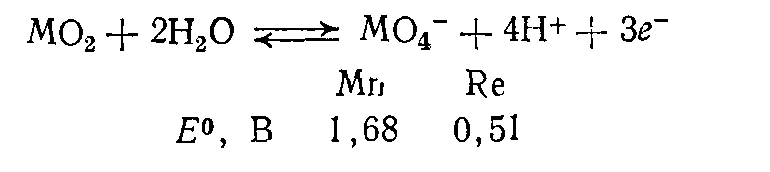
Рис. 3
Исходя из состава соединений марганца (II) допускается образование металла с более высокими степенями окисления, такие превращения могут происходить как в растворах, так и в расплавах солей.
Стабилизация степеней окисления марганцаСуществование большого числа степеней окисления у марганца химического элемента объясняется тем, что в переходных элементах во время образования связей с d-орбиталями их энергетические уровни расщепляются при тетраэдрическом, октаэдрическом и квадратном размещении лигандов. Ниже приводится таблица известных в настоящее время степеней окисления некоторых металлов в первом переходном периоде.
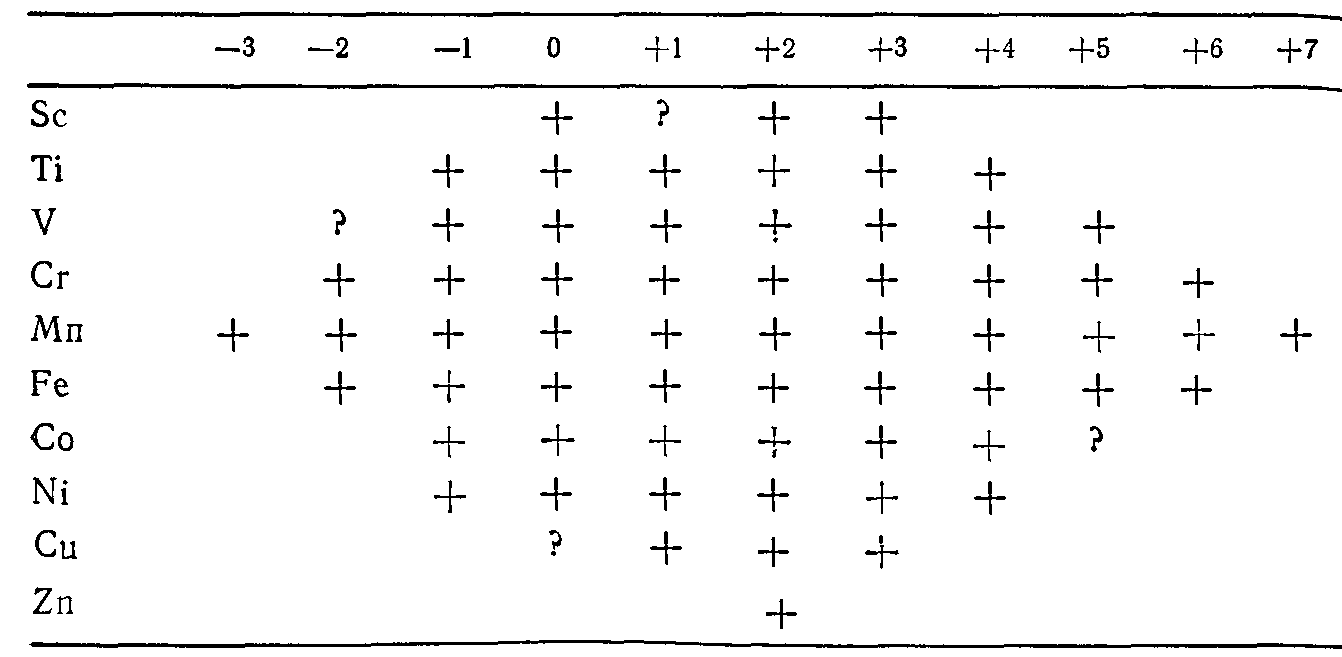
Рис. 4
Обращают на себя внимание низкие степени окисления, которые встречаются в большом ряде комплексов. В таблице есть перечень соединений, в которых лигандами являются химически нейтральные молекулы CO, NO и другие.
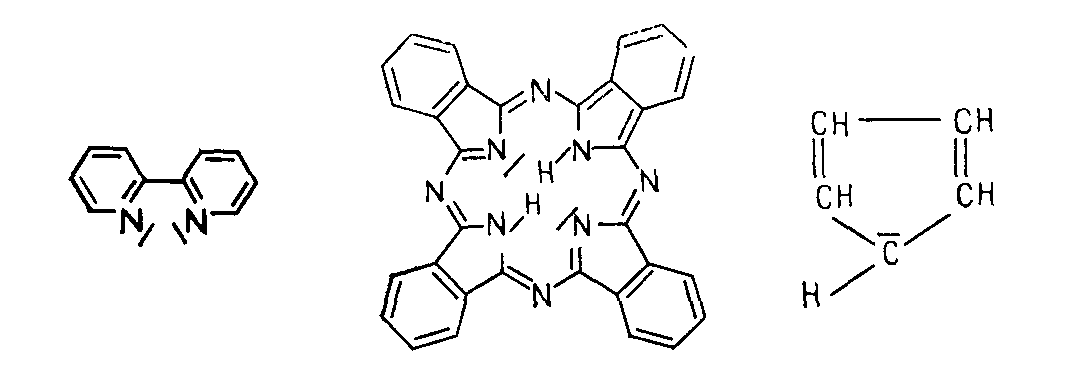
Рис. 5
За счет комплексообразования стабилизируются высокие степени окисления марганца, самыми подходящими для этого лигандами является кислород и фтор. Если принимать во внимание, что стабилизирующее координационное число равняется шести, то максимальная стабилизация равняется пяти. Если марганец химический элемент образует оксокомплексы, то могут стабилизироваться более высокие степени окисления.
Стабилизация марганца в низших степенях окисления
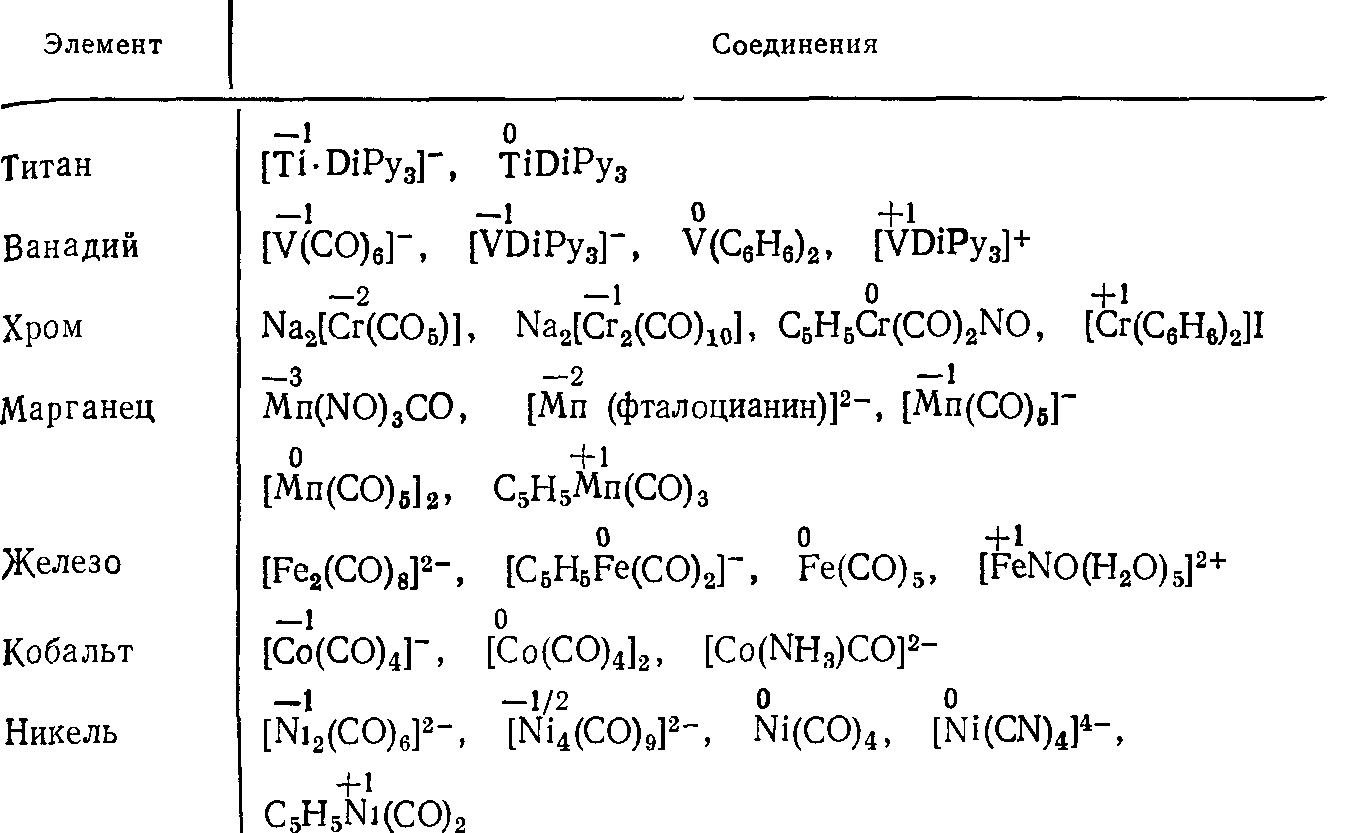
Теория мягких и жестких кислот и оснований дает возможность объяснить стабилизацию разных степеней окисления металлов за счет комплексообразования при воздействии с лигандами. Элементы мягкого типа успешно стабилизируют невысокие степени окисления металла, а жесткие положительно стабилизируют высокие степени окисления.
Теория полностью объясняет связи металл-металл, формально эти связи рассматриваются как кислотно-основное взаимное воздействие.
![]()
Рис. 6
Сплавы марганца
Активные химические свойства марганца позволяют ему образовывать сплавы со многими металлами, при этом большое количество металлов может растворяться в отдельных модификациях марганца и стабилизировать его. Медь, железо, кобальт, никель и некоторые другие металлы способны стабилизировать γ-модификацию, алюминий и серебро способны расширять β- и σ-области магния в двойных сплавах. Эти характеристики играют важную роль металлургии. Марганец химический элемент позволяет получать сплавы и высокими значениями пластичности, они поддаются штамповке, ковке и прокату.
В химических соединениях валентность марганца изменяется в пределах 2–7, увеличение степени окисления становится причиной возрастания окислительных и кислотных характеристик марганца. Все соединения Mn(+2) относятся к восстановителям. Оксид марганца имеет восстановительные свойства, серо-зеленого цвета, в воде и щелочах не растворяется, зато отлично растворяется в кислотах. Гидроксид марганца Mn(OH)3 в воде не растворяется, по цвету белое вещество. Образование Mn(+4) может быть и окислителем (а), и восстановителем (б).
MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O (а)
Эта реакция используется при необходимости получения в лабораторных условиях хлора.
MnO2 + KClO3 + 6KOH = KCl + 3K2MnO4 + 3H2O (б)
Реакция протекает при сплавлении металлов. MnO2 (оксид марганца) имеет бурый цвет, соответствующий гидроксид по цвету несколько темнее.
Физические свойства марганцаМарганец – химический элемент с плотностью 7,2–7,4 г/см3, t° плавления +1245°С, закипает при температуре +1250°С. Металлу присущи четыре полиморфные модификации:
- α-Мn. Имеет кубическую объемно-центрированную решетку, в одной элементарной ячейке располагается 58 атомов.
- β-Мn. Имеет кубическую объемно-центрированную решетку, в одной элементарной ячейке располагается 20 атомов.
- γ-Мn. Имеет тетрагональную решетку, в одной ячейке 4 атома.
- δ-Mn. Имеет кубическую объемно-центрированную решетку.
Температуры превращений марганца: α=β при t°+705°С; β=γ при t°+1090°С; γ=δ при t°+1133С. Наиболее хрупкая модификация α, в металлургии используется редко. Самыми значительными показателями пластичности отличается модификация γ, она чаще всего используется в металлургии. β-модификация частично пластична, промышленность ее применяет редко. Атомный радиус марганца химического элемента составляет 1,3 А, ионные радиусы в зависимости от валентности колеблются в пределах 0,46–0,91. Марганец парамагнитен, коэффициенты теплового расширения 22,3×10-6 град-1. Физические свойства могут немного корректироваться в зависимости от чистоты металла и его фактической валентности.
Способ получения марганца
Современная промышленность получает марганец по методу, разработанному электрохимиком В. И. Агладзе путем электрогидролиза водных растворов металла при добавлении (NH4)2SO4, во время процесса кислотность раствора должна быть в пределах рН = 8,0–8,5. В раствор погружаются свинцовые аноды и катоды из сплава на основе титана АТ-3, допускается замена титановых катодов нержавеющими. Промышленность использует порошок марганца, который после окончания процесса снимается с катодов, металл оседает в виде чешуек. Способ получения считается энергетически затратным, это оказывает прямое влияние на увеличение себестоимости. При необходимости собранный марганец в дальнейшем переплавляется, что позволяет облегчить его применение в металлургии.
Марганец – химический элемент, который можно получать и галогенным процессом за счет хлорирования руды и дальнейшим восстановлением образовавшихся галогенидов. Такая технология обеспечивает промышленность марганцем с количеством посторонних технологических примесей не более 0,1%. Более загрязненный металл получают при протекании алюмотермической реакции:
3Mn3O4 + 8Al = 9Mn + 4Al2O3
Или электротермией. Для удаления вредных выбросов в производственных цехах монтируется мощная принудительная вентиляция: воздуховоды из ПВХ, вентиляторы центробежного принципа действия. Кратность обмена воздуха регламентируется нормативными положениями и должна обеспечивать безопасное пребывание людей в рабочих зонах.
Использование марганца
Главный потребитель марганца – черная металлургия. Широкое использование металл имеет и в фармацевтической промышленности. На одну тонну выплавляемой стали необходимо 8–9 килограмм, перед введением в сплав марганца химического элемента его предварительно сплавляют с железом для получения ферромарганца. В сплаве доля марганца химического элемента составляет до 80%, углерода до 7%, остальное количество занимает железо и различные технологические примеси. За счет использования добавок значительно повышаются физико-механические характеристики сталей, выплавляемых в доменных печах. Технология пригодна и для использования добавок в современных электрических сталелитейных печах. За счет добавок высокоуглеродистого ферромарганца происходит раскисление и десульфарация стали. При добавке средне- и малоуглеродистых ферромарганцев металлургия получает легированные стали.
Низколегированная сталь имеет в составе 0,9–1,6% марганца, высоколегированная до 15%. Высокими показателями физической прочности и антикоррозионной устойчивости обладает сталь с содержанием 15% марганца и 14% хрома. Металл износоустойчив, может работать в жестких температурных условиях, не боится прямого контакта с агрессивными химическими соединениями. Такие высокие характеристики позволяют использовать сталь для изготовления наиболее ответственных конструкций и промышленных агрегатов, работающих в сложных условиях.
Марганец – химический элемент, применяемый и во время выплавки сплавов на безжелезной основе. Во время производства высокооборотных лопаток промышленных турбин используется сплав меди с марганцем, для пропеллеров применяются бронзы с содержанием марганца. Кроме этих сплавов, марганец как химический элемент присутствует в алюминиевых и магниевых. Он намного улучшает эксплуатационные характеристики цветных сплавов, делает их хорошо деформируемыми, не боящимися коррозионных процессов и износостойкими.
Легированные стали являются основным материалом для тяжелой промышленности, незаменимы во время производства различных типов вооружений. Широко применяются в кораблестроении и самолетостроении. Наличие стратегического запаса марганца – условие высокой обороноспособности любого государства. В связи с этим добыча металла ежегодно увеличивается. Кроме того, марганец – химический элемент, применяемый во время производства стекла, в сельском хозяйстве, полиграфии и т. д.
Марганец в флоре и фауне
В живой природе марганец – химический элемент, играющий важную роль в развитии. Он влияет на характеристики роста, состав крови, интенсивность процесса фотосинтеза. В растениях его количество составляет десятитысячные доли процента, а в животных стотысячные доли процента. Но даже такое незначительное содержание оказывает заметное влияние на большинство их функций. Он активирует воздействие ферментов, влияет на функцию инсулина, минеральный и кроветворный обмен. Недостаток марганца становится причиной появления различных болезней как острых, так и хронических.
Марганец – химический элемент, широко используемый в медицине. Недостаток марганца понижает физическую выносливость, становится причиной некоторых видов анемий, нарушает обменные процессы в костных тканях. Широко известны дезинфицирующие характеристики марганца, его растворы используются во время обработки некрозных тканей.
Недостаточное количество марганца в пище животных становится причиной снижения ежесуточного привеса. Для растений такая ситуация становится причиной пятнистости, ожогов, хлорозов и других заболеваний. При обнаружении признаков отравления назначается специальная медикаментозная терапия. Сильное отравление может становиться причиной появления синдрома марганцевого паркинсонизма – трудноизлечимой болезни, оказывающей негативное влияние на центральную нервную систему человека.
Суточная потребность марганца составляет до 8 мг, главное количество человек получает с пищей. При этом рацион должен быть сбалансированным по всем питательным веществам. При увеличенной нагрузке и недостаточном количестве солнечного света доза марганца корректируется на основании общего анализа крови. Значительное количество марганца содержится в грибах, водяных орехах, ряске, моллюсках и ракообразных. Содержание марганца в них может достигать нескольких десятых процента.
При попадании марганца в организм в чрезмерных дозах могут возникать болезни мышечных и костных тканей, поражаются дыхательные пути, страдает печень и селезенка. Для выведения марганца из организма требуется много времени, за этот период токсические характеристики увеличиваются с эффектом накапливания. Допустимая санитарными органами концентрация марганца в воздушной среде должна быть ≤ 0,3 мг/м3, контроль параметров выполняется в специальных лабораториях путем отбора воздуха. Алгоритм отбора регулируется государственными нормативными актами.
Применение в промышленности
Марганец в виде ферромарганца применяется для «раскисления» стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12-13 % Mn в сталь (так называемая Сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твердой и сопротивляющейся износу и ударам (эта сталь резко упрочняется и становится тверже при ударах). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
Марганец вводят в бронзы и латуни.
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
Цены на металлический марганец в слитках чистотой 95 % в 2006 году составили в среднем 2,5 долл/кг.
Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением. Теллурид марганца перспективный термоэлектрический материал(термо-э.д.с 500 мкВ/К).
Определение методами химического анализа
Марганец принадлежит к пятой аналитической группе катионов.
Специфические реакции, используемые в аналитической химии для обнаружения катионов Mn2+ следующие:
1. Едкие щёлочи с солями марганца (II) дают белый осадок гидроксида марганца (II):
Осадок на воздухе меняет цвет на бурый из-за окисления кислородом воздуха.
Выполнение реакции. К двум каплям раствора соли марганца добавляют две капли раствора щёлочи. Наблюдают изменение цвета осадка.
2. Пероксид водорода в присутствии щёлочи окисляет соли марганца (II) до тёмно-бурого соединения марганца (IV):
Выполнение реакции. К двум каплям раствора соли марганца добавляют четыре капли раствора щёлочи и две капли раствора H2O2.
3. Диоксид свинца PbO2 в присутствии концентрированной азотной кислоты при нагревании окисляет Mn2+ до MnO4− с образованием марганцевой кислоты малинового цвета:
Эта реакция дает отрицательный результат в присутствии восстановителей, например хлороводородной кислоты и её солей, так как они взаимодействуют с диоксидом свинца, а также с образовавшейся марганцевой кислотой. При больших количествах марганца эта реакция не удаётся, так как избыток ионов Mn2+ восстанавливает образующуюся марганцевую кислоту HMnO4 до MnO(OH)2, и вместо малиновой окраски появляется бурый осадок. Вместо диоксида свинца для окисления Mn2+ в MnO4− могут быть использованы другие окислители, например персульфат аммония (NH4)2S2O8 в присутствии катализатора — ионов Ag+ или висмутата натрия NaBiO3:
Выполнение реакции. В пробирку вносят стеклянным шпателем немного PbO2, а затем 5 капель концентрированной азотной кислоты HNO3 и нагревают смесь на кипящей водяной бане. В нагретую смесь добавляют 1 каплю раствора сульфата марганца (II) MnSO4 и снова нагревают 10—15 мин, встряхивая время от времени содержимое пробирки. Дают избытку диоксида свинца осесть и наблюдают малиновую окраску образовавшейся марганцевой кислоты.
При окислении висмутатом натрия реакцию проводят следующим образом. В пробирку помещают 1—2 капли раствора сульфата марганца (II) и 4 капли 6 н. HNO3, добавляют несколько крупинок висмутата натрия и встряхивают. Наблюдают появление малиновой окраски раствора.
4. Сульфид аммония (NH4)2S осаждает из раствора солей марганца сульфид марганца (II), окрашенный в телесный цвет:
Осадок легко растворяется в разбавленных минеральных кислотах и даже в уксусной кислоте.
Выполнение реакции. В пробирку помещают 2 капли раствора соли марганца (II) и добавляют 2 капли раствора сульфида аммония.
Интересные сведения об элементе
Марганец — химический элемент, интересные факты о котором могут произвести впечатление на любого человека, а также заставить понять, насколько он важен. Приведем самые основные из них, которые нашли свой отпечаток в истории данного металла.
- В тяжелые времена гражданской войны в СССР одним из первых экспортных продуктов была руда, содержащая большое количество марганца.
- Если диоксид марганца сплавить с гидроксидом калия и селитрой, а затем продукт растворить в воде, то начнутся удивительные превращения. Сначала раствор окрасится в зеленый цвет, затем окраска сменится на синий, после — фиолетовый. Наконец, станет малиновой и постепенно выпадет бурый осадок. Если же смесь встряхнуть, то снова восстановится зеленый цвет и все произойдет заново. Именно за это марганцовка и получила свое название, которое переводится, как «минеральный хамелеон».
- Если в землю вносить удобрения, содержащие марганец, то у растений повысится производительность и возрастет скорость фотосинтеза. Озимая пшеница будет лучше формировать зерна.
- Самая большая глыба минерала марганца родонита весила 47 тонн и была найдена на Урале.
- Существует тройной сплав, который называется манганин. Он состоит из таких элементов, как медь, марганец и никель. Его уникальность в том, что он обладает большим электрическим сопротивлением, которое не зависит от температуры, но находится под влиянием давления.
Конечно, это не все, что можно сказать об этом металле. Марганец — химический элемент, интересные факты о котором достаточно разнообразны. Особенно если говорить о тех свойствах, которыми он наделяет различные сплавы.
Марганец — суточная потребность
Суточная потребность в марганце среднестатистического взрослого человека составляет 1,8-3 мг3.
Максимальная суточная доза в Mn – 11 мг.
Суточная потребность Mn в зависимости от пола и возраста:
- Дети до 2х лет – 0,3 мг;
- Дети от 3 до 5 лет – 0,5-0,6 мг;
- Дети от 6 до 8 лет – 0,7-0,8 мг;
- Дети от 9 до 13 лет – 1 мг;
- Подростки от 14 до 18 лет (мальчики/девочки) – 2/1,5 мг;
- Взрослые мужчины – 3-5 мг;
- Взрослые женщины – 2,5-3 мг;
- Беременность и лактация – до 5 мг.
Суточная доза кремния повышается в следующих случаях:
- При беременности и кормлении грудью;
- Повышенная физическая и умственная нагрузка;
- Тяжелые заболевания опорно-двигательного аппарата и прочих систем.
- Терапевтической дозой марганца является — до 11 мг в сутки.
Применение марганца в медицине
В медицине применение марганца находит главным образом в виде перманганата калия («марганцовки», лат. Kalii permanganas).
Применение марганцовки целесообразно в следующих случаях:
- Антисептическое средство – для ополаскивания ротоглотки, обработки ожогов и прочих ран на коже, послеоперационная обработка, гинекологические и урологические спринцевания;
- Выведение из организма следующих токсинов (0,02-0,1% раствор) – морфина, аконитина и нескольких прочих алкалоидов;
- Промывание желудка при отравлениях.
Избыток марганца
Передозировка этим полезным микроэлементом также возможна, но только не из пищи, т.к. получить отравляющую дозу марганца из еды фактически невозможно, быстрее живот треснет.
Важно! Симптоматика появляется при суточной дозировке нутриента в 40 мг!
Отравление марганцем сопровождается следующими симптомами:
- Нарушение в работе головного мозга – заторможенность, раздражительность, компульсии;
- Нарушение аппетита, тошнота, приступы рвоты;
- Развитие паркинсонизма;
- Развитие рахита.
- https://transferfaktory.ru/marganets
- https://dic.academic.ru/dic.nsf/ruwiki/6523
- https://chem.ru/marganec.html
- http://ru.solverbook.com/spravochnik/ximiya/ximicheskie-elementy/marganec-i-ego-xarakteristiki/
- http://ru.solverbook.com/spravochnik/ximiya/valentnost/valentnost-marganca/
- https://plast-product.ru/marganets-splavyi-svoystva-rasprostranenie/
- https://FB.ru/article/198191/marganets-himicheskiy-element-svoystva-primenenie-oboznachenie-stepen-okisleniya-interesnyie-faktyi
- https://medicina.dobro-est.com/marganets-mn-rol-v-organizme-simptomyi-nedostatka-istochniki.html
Ваша оценка?