- Что представляет собой
- История – краткая справка
- Состав и структура
- Запасы, добыча
- Нахождение в природе
- Физические характеристики
- Химические свойства
- Соединения
- Соединения меди(I)
- Аналитическая химия меди
- Способы получения
- Пирометаллургический метод
- Гидрометаллургический
- Сферы применения
- Промышленность
- Строительство
- Ювелирные сплавы
- Другие сферы применения
- Биологическая роль
- Токсичность
- Органолептические свойства
- Бактерицидность
- Суточная потребность
- Продукты питания богатые медью
- Признаки нехватки меди
- Признаки избытка меди
- Отличие от других элементов
- Преимущества и недостатки
- Место меди в Периодической системе химических элементов Д.И. Менделеева
- Предостережение
Что представляет собой
Медь – это розоватый металл с золотисто-металлическим блеском. Элемент №29 периодической системы Менделеева. Международное обозначение – Cu (Cuprum).
Чистый металл мягок, поэтому чаще используется с примесями. Пластичен: вытягивается до микронных диаметров.
На воздухе покрывается пленкой, обретая желтовато-красный оттенок. Тонкие пластинки на просвет зеленовато-голубые.
По официальной классификации причислен к тяжелым цветным металлам. В эту же группу входят свинец, цинк, олово, никель.
История – краткая справка
Первые изделия из меди люди использовали еще далеко до рождения Иисуса Христа. Одни из наиболее ранее изготовленных медные предметы обнаружены на территории Турции во время раскопок старого поселения Чаталхёюк, датирующегося примерно 5600 годом до н. э. Также на Ближнем Востоке и Кипре найдены бронзовые вещи (сплав меди и олова), датируемые 3000 годом до Рождества Христова.
Медь была используемая для внутренней отделки храма Господнего, построенного Соломоном (примерно в 957-950 до Р.Х.):
«столбы числом два, море одно, и подставы, которые сделал Соломон в дом Господень, – меди во всех сих вещах не было весу. Восемнадцать локтей вышины в одном столбе; венец на нём медный, а вышина венца три локтя, и сетка и гранатовые яблоки вокруг венца – все из меди. То же и на другом столбе с сеткою.» (4Царств 25:16,17)
Изначально древние народы добывали медь из малахитовой руды.
Активное применение медь нашла во время открытия и широкого использования электричества, т.к. этот металл обладает превосходными электропроводящими свойствами.
Состав и структура
Медь — соединение огромного количества кристаллов серебра, кальция, золота, свинца, никеля. Металлы, из которых состоит купрум, отличаются простотой обработки, относительной пластичностью.
Элементарная ячейка структурной решетки — кубическая форма. Каждая из ячеек представляет собой соединение 4 атомов.
Во время добычи руда насыщена огромным количеством примесей. Они влияют на технические характеристики переплавленного металла, его структуру. Распространенные примеси:
- Кислород — примесь, содержание которой в составе может достигать 0,008%. Под воздействием высоких температур содержание кислорода быстро сокращается.
- Висмут — компонент, который негативно сказывается на технических характеристиках готового металла. Допустимое количество в составе — до 0,001%.
- Марганец — практически не влияет на свойства купрума.
- Никель — снижает теплопроводность.
- Мышьяк — не влияет на свойства переплавленного металла. Мышьяк нейтрализует негативное воздействие висмута, кислорода, сурьмы на конечный материал.
- Олово — усиливает теплопроводность.
- Сурьма — снижает тепло- и электропроводность. Допустимое содержание в составе — до 0,05%.
- Сера, селен — снижают показатель пластичности, если их количество в составе превышает 0,001%.
- Цинк — практически не влияет на физические, химические свойства.
- Фосфор — главный раскислитель. Улучшает механические свойства.
Процентное содержание примесей при производстве может уменьшаться или увеличиваться.
Медная руда
Запасы, добыча
Глобальные объемы медной руды оцениваются в миллиард тонн (разведанные). Наличие половины подтверждено. Ученые полагают, что земная кора таит еще три миллиарда тонн меденосной руды.
 Самородная медь
Самородная медь
Богатыми запасами располагают страны на всех континентах:
- Америка – Чили, Канада, США.
- Азия – Казахстан, Иран.
- Африка – ЮАР, Замбия, Заир.
На Россию приходится 3% мировых запасов. Месторождения сосредоточены на Урале. Основной добытчик – концерн «Норильский никель».
Руду добывают открытым либо закрытым способом, в зависимости от глубины залегания.
Ежегодный мировой объем добычи руды – 15-20 млн. тонн.
Нахождение в природе
Медь достаточно широко представлена в земной коре, в осадочных породах, в водах морских и пресных водоёмах, в сланцах. Распространена как в виде соединений, так и в самостоятельном варианте.
Физические характеристики
Характерный цвет медь приобретает в результате взаимодействия с кислородом и образования тонкой оксидной пленки. Более тонкие пластины на просвет выглядят зеленовато-голубыми. Наиболее ярко выраженные физические свойства меди:
- высокая электро- и теплопроводность (уступает только серебру),
- мягкость,
- пластичность,
- легко поддается вытягиванию и обработке,
- коррозионная стойкость.
Из прочих характеристик меди стоит отметить хорошую невосприимчивость к внешним природным факторам (температура, ультрафиолет, химическое воздействие) и приятный внешний вид (возможность патирования). В случаях, когда необходимо использовать более твердый материал, в ход идут латунь и бронза – сплавы меди с цинком и оловом соответственно. Медная продукция обладают высокой плотностью, может прокатываться в проволоку, пруток или лист любой толщины.
Химические свойства
На воздухе покрывается оксидной плёнкой.
Соединения
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23-, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu2O имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн.) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]- устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl-(водн.) → [CuCl]- (водн.)
Хлорид меди(I) — белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)
Образует неустойчивый комплекс с CO
CuCl+CO → Cu(CO)Cl разлагающийся при нагревании
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]-. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Способы получения
Содержание металла в рудах не превышает 2%. Поэтому перед плавкой их обогащают. Существует два способа получения меди: пиро- и гидрометаллургический.
Пирометаллургический метод
Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырье содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°:
Затем обожженный концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём
Образующийся силикат в виде шлака всплывает и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди:
Получаемая черновая медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Гидрометаллургический
Состоит в обработке сырья растворенной серной кислотой малой концентрации и выделении металлического медного продукта.
Метод оптимален для руд с минимальным процентом меди. Извлечения других компонентов не предусматривается.
Сферы применения
Свойства металла обусловили его применение разными сферами. Главный потребитель – промышленный комплекс.

Промышленность
Металл и сплавы разбирают следующие отрасли:
- Электротехника, радиоэлектроника. Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков).
- Приборо-, машиностроение. Из сплавов меди с цинком, оловом, алюминием делают детали, узлы машин. Без нее невозможно создание гальванических элементов и батарей.
- Трубы. Для транспортировки пара, воды, газа. В энергетике, судостроении, для бытовых потребностей.

Система охлаждения из меди на тепловых трубках в ноутбуке
В Японии медные трубопроводы признаны сейсмоустойчивыми, что для этой страны жизненно важно.

Медные трубы
Строительство
Крыши из медного листа экологичны, их можно не красить, поскольку влага, погодные катаклизмы не страшны. Срок службы – до 100 лет.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006.
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
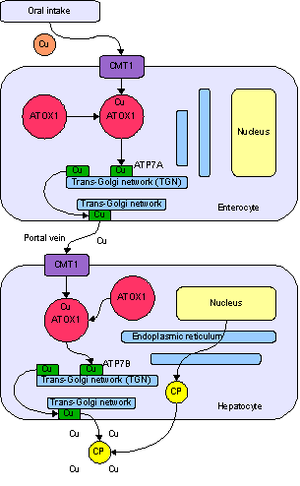 Метаболизм меди у человека. Поступление в энтероцит с помощью транспортера CMT1, перенос с помощью ATOX1 в сеть транс-Гольджи, при росте концентрации — высвобождение с помощью АТФ-азы ATP7A в воротную вену. Поступление в гепатоцит, где ATP7B нагружает ионами меди белок церулоплазмин, а избыток выводит в желчь.
Метаболизм меди у человека. Поступление в энтероцит с помощью транспортера CMT1, перенос с помощью ATOX1 в сеть транс-Гольджи, при росте концентрации — высвобождение с помощью АТФ-азы ATP7A в воротную вену. Поступление в гепатоцит, где ATP7B нагружает ионами меди белок церулоплазмин, а избыток выводит в желчь.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5] .
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла [5] . Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей. ]источник не указан 226 дней[
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью [6] (агентство подчеркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и ее сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/H1N1 (т. н. «свиной грипп»)
Суточная потребность
Суточная потребность в Cu зависит от пола, возраста, дневного рациона и места проживания человека.
Рекомендуемые суточные дозы меди:
- Младенцы от 0 до 1 года – 0,5 мг;
- Дети от 1 до 3 лет – 0,5 мг;
- Дети от 3 до 7 лет – 0,6 мг;
- Дети от 7 до 11 лет – 0,7 мг;
- Дети от 11 до 14 лет – 0,8 мг;
- Подростки от 14 до 18 лет – 1 мг;
- Взрослые и лица преклонного возраста – от 1 до 2,5-3 мг.
- Во время беременности дозировку увеличивают от нормы на 0,1 мг;
- В период кормления грудью: + 0,4 мг.
Согласно методическим рекомендациям Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека №2.3.1.1915-04 от 02.07.2004 г суточная норма меди для граждан России составляет от 1 до 5 мг. Причем 5 мг – максимально допустимая доза.
Суточная доза меди повышается при воспалительных заболеваниях, анемии, повышенной физической нагрузке, злоупотреблении алкогольными напитками, снижении реактивности иммунной системы.
Продукты питания богатые медью
Медь – один из самых важных микроэлементов для организма, поэтому продукты питания, богатые медью, должны быть в рационе каждого. Это:
- орехи, злаки, бобовые
- рыба, морепродукты
- крупы (особенно рис и гречка), макаронные изделия, ржаной хлеб
- говяжья печень, сырой яичный желток
- кисломолочные продукты
- овощи, фрукты, ягоды и зелень
- питьевая вода.
Признаки нехватки меди
Признаками недостаточного количества меди в организме служат: анемия и ухудшение дыхания, потеря аппетита, расстройства желудка, нервозность, депрессивные состояния, быстрая утомляемость, нарушения пигментации кожи и волос, ломкость и выпадение волос, сыпи на кожных покровах, частые инфекции. Возможны внутренние кровотечения.
Признаки избытка меди
Переизбыток меди характеризуется бессонницей, нарушениями мозговой активности, эпилепсией, проблемами с менструальным циклом.
Отличие от других элементов

Химически чистый металл характеризуется тремя особенностями — индивидуальным цветом (с каким медь встречается в быту), пластичностью и стойкостью к коррозии. Последнее свойство формируется благодаря образованию тонкой оксидной плёнки. Этот слой дополняет тёмно-красным оттенком цвет розовой меди, а также придаёт металлу химическую инертность в неагрессивной среде.
Для идентифицирования меди применяется спектральный анализ, требующий специального дорогостоящего приспособления — анализатора металлов, тогда как при самостоятельном анализировании потребуется набор определённых приёмов:
- Визуальное отличие медного лома от других цветных металлов. При естественном освещении чистый элемент Cu имеет красно-розовый цвет. Искусственное освещение меняет цвет меди, бывает ближе к жёлто-зелёному тону.
- Устранение поверхностной оксидной плёнки. Для этого нужно нарушить верхний слой при помощи напильника.
Сложнее будет отличить чистый элемент от медных сплавов: латуни и бронзы, а также омеднённого алюминия. В составе латуни содержатся медь и цинк, наличие которого колеблется от 4 до 45%. При высоком проценте содержания примеси отличить от чистого металла будет несложно, так как цвет латуни будет более светлым.
При возрастании количества цинка в сплаве происходит смещение от красного тона к жёлтому. Следовательно высокомедную латунь с 10% содержанием примесей зрительно можно принять за чистую медь. Однако есть три варианта, благодаря которым можно сделать различие:
- Определение по звуку. При ударе по металлу мягкая медь будет издавать приглушённый звук, а латунь звонкий. Такой метод результативно работает для крупногабаритных изделий, например, труб.
- По сгибу. Её можно легко согнуть, тогда как более жёсткая латунь менее податлива.
- По весу. Плотность Cu 9 г/куб. см. Это выше, чем у цинка (7,1). Латунь характеризуется величиной в среднем 8,6 г/куб. см.
Идентифицировать медь можно также по металлической стружке: медная имеет форму спирали, латунная прямую, игольчатую. Можно использовать химические вещества, например, соляную кислоту. Медь не будет реагировать, находясь в растворе, а поверхность латуни покроется белым налётом, называющимся хлоридом цинка, — результат реакции.
Преимущества и недостатки
Преимущества:
- Устойчивость к образованию ржавчины.
- Привлекательный вид.
- Высокий показатель теплопроводности.
- Пластичность, гибкость, прочность.
- Низкое сопротивление.
Главный недостаток — высокая цена.
Место меди в Периодической системе химических элементов Д.И. Менделеева
Медь расположена в 11 группе Периодической системы химических элементов Д.И. Менделеева. В четвертом периоде медь является предпоследним d-элементом, её валентные электроны 3d94s2, однако вследствие устойчивости d10-состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию: 3d104s1. В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
Предостережение
В составе металла есть изотопы: два стабильных плюс два десятка нестабильных. Хотя период полураспада «долгожителя» – менее 2,5 суток, материал токсичен.
Поэтому применение меди контролируется.
В России на федеральном уровне (национальный стандарт, федеральный Свод Правил) регламентируется:
- Производство и использование медных водо- паро- и газопроводных труб.
- Количество меди в питьевой воде.
В 1 литре питьевой воды не должно быть больше 1 мг меди.
Избыток медных компонентов вызывает отравление организма. Для приготовления пищи медная посуда непригодна.
Карьер, в котором медную руду извлекали открытым способом, становится источником токсичных соединений.
- https://jgems.ru/metally/med
- https://medicina.dobro-est.com/med-cu-rol-v-organizme-simptomyi-nedostatka-istochniki.html
- https://metalloy.ru/metally/med
- https://calorizator.ru/element/cu
- https://cuprum-metall.ru/informatsiya/med/
- http://himsnab-spb.ru/article/ps/cu/
- https://www.yoursystemeducation.com/med/
- https://othodynet.ru/othody/med-tsvet-osobennosti-dobychi-harakteristika-metalla
- http://himege.ru/med-ximicheskie-svojstva/
Ваша оценка?