- Что такое валентность
- Для чего нужна валентность?
- В чем отличие валентности и степени окисления
- Какие бывают характеристики у валентности элементов?
- Влияние валентности элементов в химических реакциях.
- Как определить валентность элемента
- Определение по таблице Менделеева
- Формула и алгоритм
- Современные представления
- В качестве примера
- Правило октета
- Определение зависимости от химических формул
- Необычные способы определения валентности элементов.
- Элементы, имеющие несколько значений валентности
- Таблица валентности химических элементов.
Что такое валентность
Валентность – способность атома элемента образовывать связь с другими атомами за счёт электронов, находящихся на внешнем энергетическом уровне.
Любой элемент состоит из атома, в центре которого находится положительно заряженное ядро. Заряд ядра соответствует порядковому номеру элемента в периодической таблице. Он всегда положителен, так как количество протонов превышает количество нейтронов.
Вокруг ядра движутся на разном расстоянии от ядра отрицательно заряженные электроны. Их количество также соответствует порядковому номеру элемента. Самый последний уровень занимают валентные электроны. Из-за большого расстояния от ядра они теряют с ним связь и легко спариваются с внешними электронами другого атома. За счёт образовавшейся ковалентной связи формируется новое вещество, состоящее из нескольких атомов.

Рис. 1. Строение атома углерода.
Количество электронов на внешнем уровне определяет валентность элемента и, соответственно, количество возможных химических связей.
Для чего нужна валентность?
Валентность химических элементов – это способность атомов элемента образовывать химические связи, то есть присоединять к себе другие атомы. Количественной мерой валентности является число связей, которые образует данный атом с другими атомами или атомными группами.
В настоящее время валентность представляет собой число ковалентных связей (в том числе возникших и по донорно-акцепторному механизму), которыми данный атом соединен с другими. При этом не учитывается полярность связей, а значит, валентность не имеет знака и не может быть равной нулю.
Ковалентная химическая связь – это связь, осуществляемая за счет образования общих (связывающих) электронных пар. Если между двумя атомами имеется одна общая электронная пара, то такая связь называется одинарной, если две – двойной, если три – тройной.
В чем отличие валентности и степени окисления
Валентность и степень окисления не являются равнозначными понятиями, хоть их числовое значение может совпадать.
Валентность используется для определения числа химических связей атома, причем как полярных, так и неполярных.
Степень окисления используется для выражения значения электрического заряда, сосредоточенного на атоме.
Какие бывают характеристики у валентности элементов?
Все вещества, которые обладают валентностью, характеризуются тем, что она у них или постоянна (во всех связях), либо переменная. Постоянная валентность – характеристика очень небольшой группы веществ (водорода, фтора, натрия, калия, кислорода и др. Намного больше в мире атомов, которые обладают переменной валентностью. В разных реакциях, взаимодействуя с разными атомами, они становятся разновалентными. Например, азот в соединении NH3 имеет валентность – III, так как связан с тремя атомами, а в природе он бывает с валентность от одного до четырех. Еще раз повторю, что разная валентность – более распространенное явление.
Влияние валентности элементов в химических реакциях.
Даже того как ученые узнали, что атом — это не мельчайшая частица в мире, они уже оперировали этим понятием. Они понимали, что есть внутренний фактор, который влияет на протекание химической реакции различных веществ. Из-за того, что ученые по-разному видели строение молекулы, понятие «валентность элемента» пережило несколько метаморфоз.
Валентность вещества определяется количеством внешних электронов атома. Каким количеством электронов атом обладает, столько максимально соединений он способен совершить. Таким образом «валентность» подразумевает собою число электронных пар атомов.
Хотя электронная теория появилась намного позже, после «разделения» атома на более мелкие частицы, до этого ученые все равно вполне успешно определяли валентность в большинстве случаев. Удавалось им это благодаря химическому анализу веществ.
Это была тяжелая работа: прежде всего, требовалось определить массу элемента в чистом виде. Далее, с помощью химического анализа, ученые определяли каков состав соединения, и только потом могли высчитать, сколько атомов содержит в себе молекула вещества.
Этот метод все еще используется, но не является универсальным. Так удобно определять элемент в простом соединении веществ. Например, с одновалентным водородом, или двухвалентным кислородом.
Но уже при работе с кислотами метод не особо удачный. Нет, мы можем частично использовать его, например, при определении валентности соединений кислотных остатков.
Выглядит это так: используя знание, что валентность кислорода всегда равна двум, мы можем с легкостью высчитать валентность всего кислотного остатка. Например, в H2SO3 валентность SO3 – I, в HСlO3 валентность СlO3 – I.
Как определить валентность элемента
Для этого существует несколько методов. Первый и самый простой способ — это просто обратиться к периодической таблице Менделеева. Элементы распределены по группам, их 8. В каждой группе они имеют одинаковую валентность. Например, все элементы в группе 8 имеют восемь электронов (высокая стабильность).
Второй метод — посмотреть на общее количество электронов, а затем вычислить их число по атомному номеру. Как только вы узнаете количество электронов, вы можете легко вычислить валентность. Все атомы, кроме водорода, имеют два электрона в первой электронной оболочке и до восьми в каждой последующей. Например, атомный номер хлора равен 17, что делает конфигурацию электронов равной:
- 2;
- 8;
- 7.
То есть валентность хлора равна 7. Кислород имеет восемь электронов, два в первой оболочке и шесть во внешних оболочках, давая ему число 2. Вы можете рассчитать многоэлементные молекулы таким же образом. Например, чтобы определить тетраоксид фосфора, вы должны умножить атомы кислорода (валентность 2) и вычесть из валентности фосфора 5, получив число 3.
Ознакомьтесь с электронной конфигурацией каждого уровня оболочки. Каждый атом имеет два электрона на своей внутренней оболочке и до восьми электронов на каждой оболочке. Например, поскольку литий имеет три электрона, он будет иметь два внутри и один электрон на своей внешней оболочке.

Определение по таблице Менделеева
Таблица Менделеева позволяет с легкостью определять основность элементов. Для этого нужно уметь читать периодическую таблицу. Таблица по вертикали имеет восемь групп, а по горизонтали располагаются периоды. Если период состоит из двух рядов, то его называют большим, а если из одной — малым. Элементы по вертикали в столбцах, в группах распределены неравномерно. Валентность всегда обозначается римскими цифрами.
Чтобы определить валентность, нужно знать, какая она бывает. У металлов главных подгрупп она всегда постоянная, а у неметаллов и металлов побочных подгрупп может быть переменной.
Постоянная равна номеру группы. Переменная может быть высшей и низшей. Высшая переменная равна номеру группы, а низкая высчитывается по формуле: восемь минус номер группы. При определении нужно помнить:
- у водорода она равна I;
- у кислорода — II.
Если соединение имеет атом водорода или кислорода, то определить его валентность не составляет труда, особенно если перед нами гидрид или оксид.
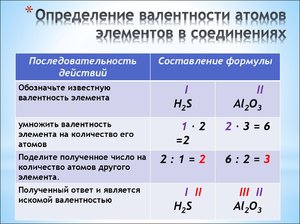
Формула и алгоритм
Самая меньшая валентность у тех элементов, которые расположены правее и выше в таблице. И, наоборот, если элемент ниже и левее, то она будет выше. Чтобы определить ее, необходимо следовать универсальному алгоритму:

- Записываем формулу соединения.
- Проставляем валентность того компонента соединения, которого знаем.
- Умножаем известную величину на количество атомов элемента в соединении.
- Находим наименьшее кратное.
- Проводим проверку: умножаем значение на индекс. Должна получаться одинаковая цифра по каждому компоненту соединения.
Пример: возьмем соединение аммиака — NH3. Нам известно, что у атома водорода валентность постоянная и равна I. Умножаем I на 3 (количество атомов) — наименьшее кратное — 3. У азота в этой формуле индекс равен единице. Отсюда вывод: 3 делим на 1 и получаем, что у азота она равна IIII.
Величину по водороду и кислороду всегда определять легко. Сложнее, когда ее необходимо определять без них. Например, соединение SiCl4. Как определить валентность элементов в этом случае? Хлор находится в 7 группе. Значит, его валентность либо 7, либо 1 (восемь минус номер группы). Кремний находится в четвертой группе, значит, его потенциал для образования связей равен четырем. Становится логично, что хлор проявляет в этой ситуации наименьшую валентность и она равна I.
В современных учебниках химии всегда есть таблица валентности химических элементов. Это существенно облегчает задачу учащимся. Тему изучают в восьмом классе — в курсе неорганической химии.
Современные представления
Современные представления о валентности базируются на строении атомов. Атом состоит из ядра и вращающихся на орбиталях электронах.
Само ядро состоит из протонов и нейтронов, которые определяют атомный вес. Для того чтобы вещество было стабильным, его энергетические уровни должны быть заполнены и иметь восемь электронов.
При взаимодействии элементы стремятся к стабильности и либо отдают свои неспаренные электроны, либо принимают их. Взаимодействие происходит по принципу «что легче» — отдать или принять электроны. От этого также зависит то, как изменяется валентность в таблице Менделеева. Количество неспаренных электронов на внешней энергетической орбитали равно номеру группы.
В качестве примера
Щелочной металл натрий находится в первой группе периодической системы Менделеева. Это значит, что у него один неспаренный электрон на внешнем энергетическом уровне. Хлор находится в седьмой группе. Это значит, что у хлора есть семь неспаренных электронов. Для завершения энергетического уровня хлору не хватает ровно одного электрона. Натрий отдает ему свой электрон и становится стабильным в соединении. Хлор же получает дополнительный электрон и тоже становится стабильным. В итоге появляется связь и прочное соединение — NaCl — знаменитая поваренная соль. Валентность хлора и натрия в этом случае будет равна 1.
Правило октета
При определении атома или молекулы (для которой вы не можете использовать периодическую таблицу), химики используют правило октета. Согласно этому правилу, атомы и химические вещества объединяются таким образом, чтобы образовать восемь электронов во внешней оболочке любого соединения, которое они образуют. Когда атом или молекула имеет от одного до четырех электронов в своей внешней оболочке, он имеет положительную валентность, то есть он жертвует свои свободные электроны. Когда число электронов составляет:
- четыре;
- пять;
- шесть;
- семь;
— вы определяете его способности путем вычитания электронного числа из 8. Это потому, что атом или молекула легче принимает электроны для достижения стабильности.
Определение зависимости от химических формул
Вы можете определить переходный элемент или радикал в конкретном соединении, заметив, как он сочетается с элементами известной валентности. Эта стратегия основана на правиле октета, которое говорит нам о том, что элементы и радикалы объединяются, чтобы создать стабильную внешнюю оболочку из восьми электронов.
В качестве простых иллюстраций этой стратегии обратите внимание, что натрий (Na), имеющий +1, легко сочетается с хлором (Cl), который имеет -1, с образованием хлорида натрия (NaCl) или поваренной соли. Это пример ионной реакции, в которой электрон пожертвован одним атомом и принят другим. Однако для соединения с серой (S) требуется два атома натрия с образованием сульфида натрия (Na2S), сильнощелочной соли, используемой в целлюлозной промышленности.
Чтобы применить эту стратегию к более сложным молекулам, важно сначала понять, что элементы иногда объединяются с образованием реактивных радикалов, которые еще не достигли стабильности внешней оболочки. Примером является сульфатный радикал (SO4). Это тетраэдрическая молекула, в которой атом серы разделяет электроны с четырьмя атомами кислорода в так называемой ковалентной связи. В таком соединении вы не можете получить валентность атомов в радикале, если посмотреть на формулу. Поскольку для образования этого соединения требуется два атома натрия, валентность серы должна быть -2.
Однако вы можете определить радикал с помощью ионных соединений, которые он образует. Например, сульфатный радикал объединяется ионно с водородом, образуя серную кислоту (H2SO4). Эта молекула содержит два атома водорода, каждая из которых имеет +1, поэтому в этом случае валентность радикала равна -2. Как только вы определили радикал, вы можете использовать ее для вычисления молекул, с которыми он объединяется.
Например, железо (Fe) представляет собой переходный металл, который может проявлять множественные валентности. Когда он сочетается с сульфатным радикалом с образованием сульфата железа, FeSO4, он должен иметь +2 поскольку сульфатный радикал, определяется по связи, которую он образует с водородом.
Необычные способы определения валентности элементов.
Есть и более нестандартные, но интересные способы определения валентности вещества. Если хорошо знать свойства элемента, то определить валентность можно даже визуально. Например, медь. Ее оксиды будут красными и черными, а гидроксиды – желтыми и синими.
Элементы, имеющие несколько значений валентности
Значение валентности зависит от состояния атома — обычного или возбужденного.
Не все атомы химических элементов могут переходить в возбужденное состояние. По этому признаку они делятся на химические элементы с переменной и постоянной валентностью.
Постоянная валентность наблюдается у щелочных, щелочноземельных металлов, водорода, кислорода, фтора и алюминия.
Все остальные химические элементы обладают переменной валентностью, обусловленными существованием как возбужденных, так и обычных (стационарных) состояний.
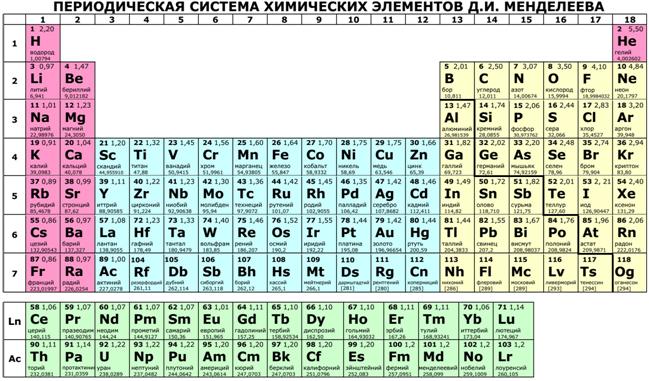
Таблица валентности химических элементов.
| Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра, он же: атомное число | Русское / Английское наименование | Химический символ | Валентность |
| 1 | Водород / Hydrogen | H | (-1), +1 |
| 2 | Гелий / Helium | He | |
| 3 | Литий / Lithium | Li | +1 |
| 4 | Бериллий / Beryllium | Be | +2 |
| 5 | Бор / Boron | B | -3, +3 |
| 6 | Углерод / Carbon | C | (+2), +4 |
| 7 | Азот / Nitrogen | N | -3, -2, -1, (+1), +2, +3, +4, +5 |
| 8 | Кислород / Oxygen | O | -2 |
| 9 | Фтор / Fluorine | F | -1, (+1) |
| 10 | Неон / Neon | Ne | |
| 11 | Натрий / Sodium | Na | +1 |
| 12 | Магний / Magnesium | Mg | +2 |
| 13 | Алюминий / Aluminum | Al | +3 |
| 14 | Кремний / Silicon | Si | -4, (+2), +4 |
| 15 | Фосфор / Phosphorus | P | -3, +1, +3, +5 |
| 16 | Сера / Sulfur | S | -2, +2, +4, +6 |
| 17 | Хлор / Chlorine | Cl | -1, +1, (+2), +3, (+4), +5, +7 |
| 18 | Аргон / Argon | Ar | |
| 19 | Калий / Potassium | K | +1 |
| 20 | Кальций / Calcium | Ca | +2 |
| 21 | Скандий / Scandium | Sc | +3 |
| 22 | Титан / Titanium | Ti | +2, +3, +4 |
| 23 | Ванадий / Vanadium | V | +2, +3, +4, +5 |
| 24 | Хром / Chromium | Cr | +2, +3, +6 |
| 25 | Марганец / Manganese | Mn | +2, (+3), +4, (+6), +7 |
| 26 | Железо / Iron | Fe | +2, +3, (+4), (+6) |
| 27 | Кобальт / Cobalt | Co | +2, +3, (+4) |
| 28 | Никель / Nickel | Ni | (+1), +2, (+3), (+4) |
| 29 | Медь / Copper | Сu | +1, +2, (+3) |
| 30 | Цинк / Zinc | Zn | +2 |
| 31 | Галлий / Gallium | Ga | (+2). +3 |
| 32 | Германий / Germanium | Ge | -4, +2, +4 |
| 33 | Мышьяк / Arsenic | As | -3, (+2), +3, +5 |
| 34 | Селен / Selenium | Se | -2, (+2), +4, +6 |
| 35 | Бром / Bromine | Br | -1, +1, (+3), (+4), +5 |
| 36 | Криптон / Krypton | Kr | |
| 37 | Рубидий / Rubidium | Rb | +1 |
| 38 | Стронций / Strontium | Sr | +2 |
| 39 | Иттрий / Yttrium | Y | +3 |
| 40 | Цирконий / Zirconium | Zr | (+2), (+3), +4 |
| 41 | Ниобий / Niobium | Nb | (+2), +3, (+4), +5 |
| 42 | Молибден / Molybdenum | Mo | (+2), +3, (+4), (+5), +6 |
| 43 | Технеций / Technetium | Tc | +6 |
| 44 | Рутений / Ruthenium | Ru | (+2), +3, +4, (+6), (+7), +8 |
| 45 | Родий / Rhodium | Rh | (+2), (+3), +4, (+6) |
| 46 | Палладий / Palladium | Pd | +2, +4, (+6) |
| 47 | Серебро / Silver | Ag | +1, (+2), (+3) |
| 48 | Кадмий / Cadmium | Cd | (+1), +2 |
| 49 | Индий / Indium | In | (+1), (+2), +3 |
| 50 | Олово / Tin | Sn | +2, +4 |
| 51 | Сурьма / Antimony | Sb | -3, +3, (+4), +5 |
| 52 | Теллур / Tellurium | Te | -2, (+2), +4, +6 |
| 53 | Иод / Iodine | I | -1, +1, (+3), (+4), +5, +7 |
| 54 | Ксенон / Xenon | Xe | |
| 55 | Цезий / Cesium | Cs | +1 |
| 56 | Барий / Barium | Ba | +2 |
| 57 | Лантан / Lanthanum | La | +3 |
| 58 | Церий / Cerium | Ce | +3, +4 |
| 59 | Празеодим / Praseodymium | Pr | +3 |
| 60 | Неодим / Neodymium | Nd | +3, +4 |
| 61 | Прометий / Promethium | Pm | +3 |
| 62 | Самарий / Samarium | Sm | (+2), +3 |
| 63 | Европий / Europium | Eu | (+2), +3 |
| 64 | Гадолиний / Gadolinium | Gd | +3 |
| 65 | Тербий / Terbium | Tb | +3, +4 |
| 66 | Диспрозий / Dysprosium | Dy | +3 |
| 67 | Гольмий / Holmium | Ho | +3 |
| 68 | Эрбий / Erbium | Er | +3 |
| 69 | Тулий / Thulium | Tm | (+2), +3 |
| 70 | Иттербий / Ytterbium | Yb | (+2), +3 |
| 71 | Лютеций / Lutetium | Lu | +3 |
| 72 | Гафний / Hafnium | Hf | +4 |
| 73 | Тантал / Tantalum | Ta | (+3), (+4), +5 |
| 74 | Вольфрам / Tungsten | W | (+2), (+3), (+4), (+5), +6 |
| 75 | Рений / Rhenium | Re | (-1), (+1), +2, (+3), +4, (+5), +6, +7 |
| 76 | Осмий / Osmium | Os | (+2), +3, +4, +6, +8 |
| 77 | Иридий / Iridium | Ir | (+1), (+2), +3, +4, +6 |
| 78 | Платина / Platinum | Pt | (+1), +2, (+3), +4, +6 |
| 79 | Золото / Gold | Au | +1, (+2), +3 |
| 80 | Ртуть / Mercury | Hg | +1, +2 |
| 81 | Талий / Thallium | Tl | +1, (+2), +3 |
| 82 | Свинец / Lead | Pb | +2, +4 |
| 83 | Висмут / Bismuth | Bi | (-3), (+2), +3, (+4), (+5) |
| 84 | Полоний / Polonium | Po | (-2), +2, +4, (+6) |
| 85 | Астат / Astatine | At | нет данных |
| 86 | Радон / Radon | Rn | |
| 87 | Франций / Francium | Fr | нет данных |
| 88 | Радий / Radium | Ra | +2 |
| 89 | Актиний / Actinium | Ac | +3 |
| 90 | Торий / Thorium | Th | +4 |
| 91 | Проактиний / Protactinium | Pa | +5 |
| 92 | Уран / Uranium | U | (+2), +3, +4, (+5), +6 |
Чего не указано в таблице валентности, это то, что валентность элемента может быть постоянной и переменной.
| Виды валентности | |
| Постоянная (у металлов главных подгрупп) | Переменная (у неметаллов и металлов побочных подгрупп) |
| Высшая (равна номеру группы) | Низшая (равна разности между числом 8 и номером группы) |
Знание валентности элементов необходимы для правильного составления химических формул соединений.
- https://obrazovaka.ru/himiya/tablica-valentnosti-himicheskih-elementov-8-klass.html
- https://obrazovaka.ru/himiya/valentnost-himicheskih-elementov.html
- https://wika.tutoronline.ru/himiya/class/11/valentnye-vozmozhnosti-atomov
- https://www.calc.ru/Valentnost-Elementov.html
- https://LivePosts.ru/articles/education-articles/himiya/kak-opredelit-valentnost-himicheskogo-elementa-po-tablitse
- https://obrazovanie.guru/himiya/kak-opredelit-valentnost-elementa-po-tablitse-mendeleeva.html
- https://www.calc.ru/Tablitsa-Valentnosti.html
Ваша оценка?









