- Что такое галогены
- Перечень галогенов
- Положение галогенов в периодической системе и строение атомов
- Распространённость элементов и получение простых веществ
- Химические свойства галогенов
- Физические свойства галогенов
- Растворимость галогенов
- Получение
- Получение хлора
- Фтор
- Получение йода
- Получение брома
- Применение
- Биологическая роль галогенов
- Токсичность галогенов
Что такое галогены
Определяют, как элементы 17-ой группы таблицы Менделеева. Сторонники «старой школы» выразились бы: «главной подгруппы VII группы».
Название представляет собой компиляцию греческих слов. Означает приблизительно «солерождающий». Такое определение было дано в XIX веке британским ученым Гэмфри Дэви.
Перечень галогенов
Галогены являются хорошими окислителями, по этой причине в природе их можно встретить только в каких-либо соединениях. Чем выше порядковый номер, тем химическая активность элементов этой группы меньше. К группе галогенов относятся нижеперечисленные элементы:
- хлор (Cl);
- фтор (F);
- иод (I);
- бром (Br);
- астат (At).
Последний разработан в институте ядерных исследований, который расположен в городе Дубна. Фтор относится к ядовитым газам бледно-жёлтого цвета. Хлор также ядовит. Это газ, имеющий довольно резкий и неприятный запах светло-зелёного цвета. Бром имеет красно-бурый окрас, это ядовитая жидкость, которая может даже поражать обоняние. Он очень летуч, поэтому его хранят в ампулах. Йод — кристаллическое легко возгоняющееся вещество тёмно-фиолетового цвета. Астат радиоактивен, цвет кристаллов: чёрный с синевой, период полураспада составляет 8,1 часа.
Положение галогенов в периодической системе и строение атомов
Слово «галоген» произошло от греческих «хальс» –соль и «генос» –рождаю, буквально: рождающий соль.
Это название изначально было предложено для хлора, так как хлор был получен электролизом поваренной соли.

А уже в дальнейшем это название распространилось на фтор F, бром Br и йод I.
Таким образом, галогены – это химические элементы главной подгруппы VII группы периодической системы химических элементов:
- фтор F
- хлор Сl
- бром Вг
- йод I
- астат At
Галогены – элементы, у которых наиболее ярко выражены свойства неметаллов.
В свободном виде они в природе не встречаются!
Наиболее распространенные минералы, в состав которых входят галогены:
CaF2– флюорит (плавиковый шпат)
NaCl– галит (каменная соль)
КСl х NaCl– сильвинит
MgCl2 х 6Н20 – бишофит.

Бром Br и йод I встречаются в виде соединений в природных водах.
Морские водоросли ламинарии активно накапливают йод и поэтому являются источником для его получения.
Астат At – радиоактивный элемент и поэтому его свойства не изучены.
Название «астат» переводится с греческого языка «неустойчивый».
Он был предсказан ещё Дмитрием Менделеевым, который назвал его «эка-йод».
По оценкам учёных, во всей земной коре этого элемента насчитывается около 1 грамма (!), он постоянно образуется в процессе распада урана, но и столь же быстро распадается.
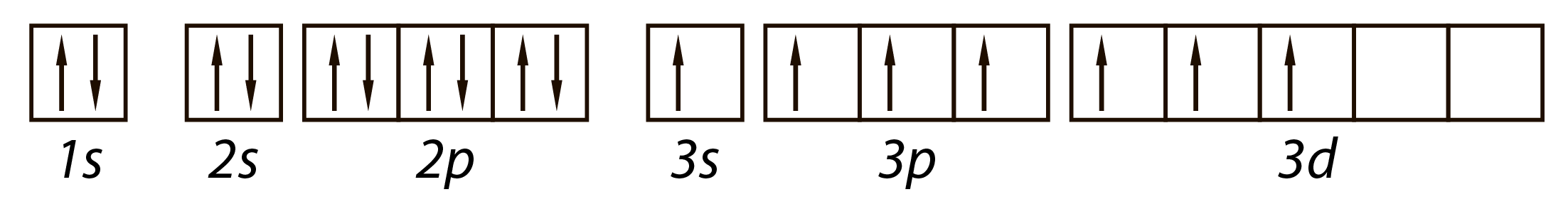
На внешнем энергетическом уровне у всех атомов галогенов по семь электронов.
Этим объясняется общность их свойств.
Атомы галогенов легко присоединяют по одному электрону, проявляя в соединениях степень окисления -1.
Однако эти элементы, за исключением фтора, могут проявлять и положительные степени окисления: +1, +3, +5, +7.
Разнообразие значений степеней окисления объясняется электронным строением атомов, а точнее, внешними электронами.
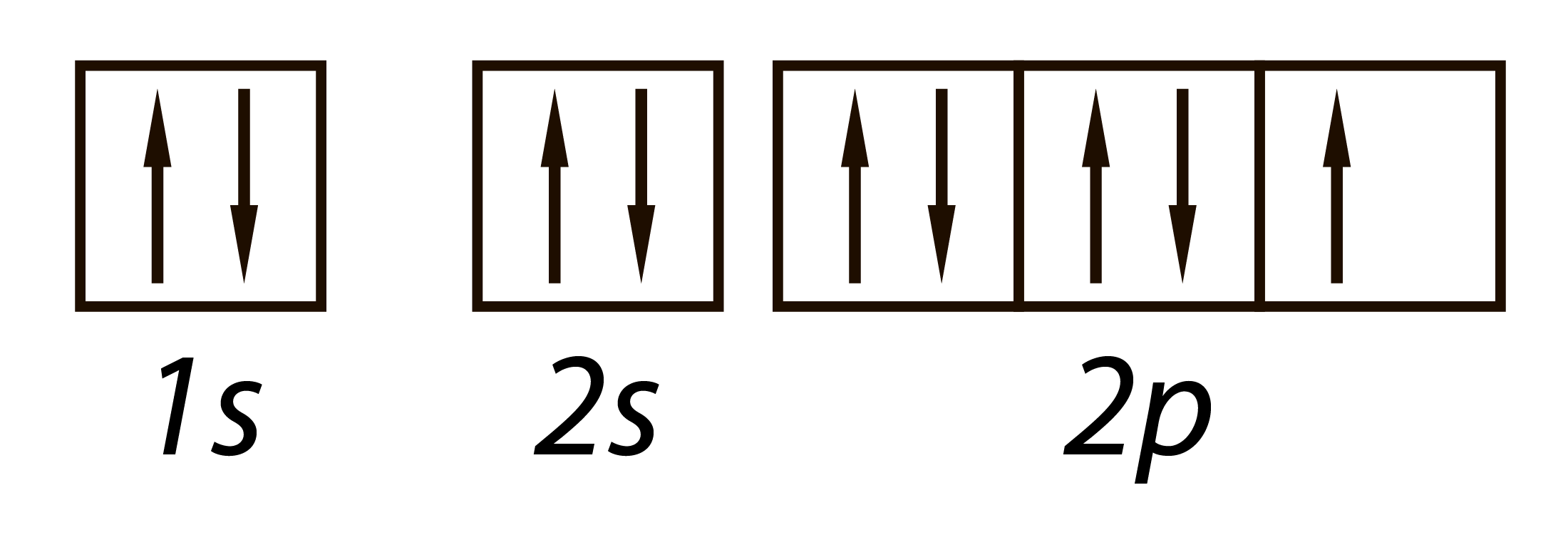
Из электронного строения атома фтора следует, что фтор может принять только один электрон на 2s-подуровень.
Поэтому он одновалентен и его степень окисления всегда -1.
Кроме того, это самый электроотрицательный элемент – ни один другой элемент просто-напросто не способен отнять у атома фтора электрон.
Электронное строение атома фтора:
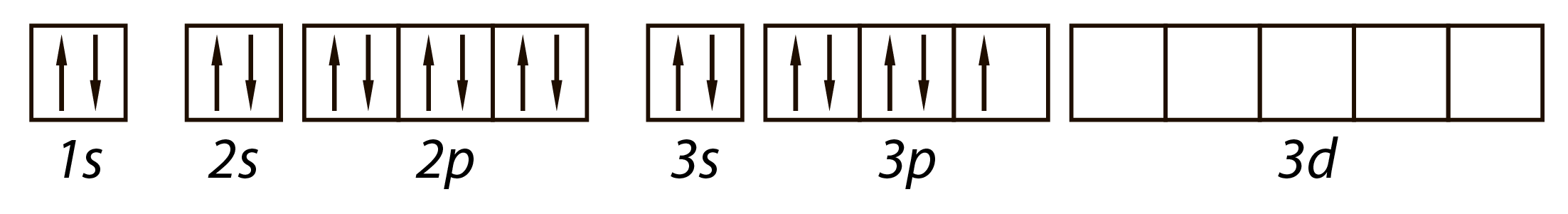
Атом хлора Cl в обычном состоянии имеет один электрон и может принять один электрон, проявляя степень окисления -1.
Однако у атома хлора имеется еще пять пустых 3d-орбиталей, и поэтому, если сообщить атому энергию, то возможен перескок электронов c 3s и 3p орбиталей на 3d орбитали, и тогда количество неспаренных электронов увеличивается и может быть 3, 5 или 7.
Поэтому возможные степени окисления хлора: +1, +3, +5, +7.
На схеме ниже показано электронное строение атома хлора в основном и в возбужденном состояниях.
Из схемы видно, почему максимальная валентность хлора равна 7.
Распространённость элементов и получение простых веществ
Чем больше величина атомного радиуса, тем меньше наличие солеродов в теле планеты. Величина r – радиуса атома фтора, по сравнению с радиусом атома иода, говорит о том, что фтор более распространён, нежели йод. Астата в коре планеты всего лишь граммы.
Промышленность производит галоиды (устаревшее название) в больших объёмах. При этом по количеству изготовленной продукции лидирует хлор.
Простые вещества получают при помощи галогенидов, окисляя их. Для этого используется электролитическое окисление. Причём из-за того, что положительные потенциалы у фтора и хлора достаточно высокие, приходится применять сильные окислители.
Важно! Электролиз фтора осложнён невозможностью использования водных растворов. Его потенциал окисления выше, и он может вступать в реакцию с водой, поэтому используют плавиковую кислоту.
Электролиз NaCl с применением анодов из графита позволяет добывать хлор. Катоды при этом могут быть:
- железные;
- жидкие ртутные;
- стальные.
Уравнение, описывающее эту реакцию, имеет вид:
2Cl- —› Cl2 (г.) + 2е-.
Выполняя химическое окисление бромида-иона из морской воды, получают бром.
Так же добывают и йод, используя насыщенные им рассолы. Оба процесса проводят, применяя хлор в виде окислителя. Воздушным потоком, проходящим через раствор, удаляются I2 и Br2.
Химические свойства галогенов
Способность вступать в реакцию с разными веществами под воздействием сторонних факторов индивидуальна для каждого из рассматриваемых элементов.
Химические особенности солеродов
При вступлении галогенов в связь с медью (малоактивный металл) получаются галогениды с формулой:
CuHal2, где Hal2 – солероды Br, Cl, F.
Когда галогениды вступают в реакцию с галогенами, то тот солерод, который активнее, вытесняет малоактивный из его же раствора. Хлор, являясь окислителем, вступает во взаимодействие в смесях солей йода и брома. Бром не реагирует на хлориды, но может из иодидов выдавить йод.
При воздействии на органические соединения при хлорировании воды или йодировании соли происходит галогенирование. При этом атом галогена вводится в соединение. Галогенирование может осуществляться замещением, расщеплением или присоединением атома солерода к атомной структуре органических соединений.
Интересно. Йод, имея низкие окислительные способности, не выдавливает из солей галогены. С фтором реакции водных сульфитов вообще не получаются, он вступает в содействие с Н2О.
Физические свойства галогенов
Это характеристики, описывающие цвет, запах, температуры изменения свойств, а также агрегатное пребывание в нормальных условиях.
Физические свойства простых двухатомных веществ
Внимание! Такие токсичные вещества, как галогены, образовывают взаимные соединения: BrCl, ICl, IBr и иные. Три состояния (твёрдое, жидкое и газообразное) присущи солеродам при комнатной температуре.
Растворимость галогенов
Молекулы галогенов неполярны и, как обычно для неполярных веществ, умеренно растворимы в воде (за исключением фтора, который энергично взаимодействует с водой), причем растворимость брома максимальна. Один объем воды растворяет при комнатной температуре около 2,5 объемов хлора. Этот раствор называется хлорной водой (для брома и йода – бромная и йодная вода соответственно). При пропускании хлора в охлажденную до 0 °C воду из раствора выделяются зеленовато-желтые кристаллы клатратных соединений Cl2·8H2O и Cl2·6H2O. Это вещество плавится инконгруэнтно при 9,6 °C.
Значительно лучше неполярные галогены растворяются в неполярных органических растворителях (за исключением хлора и фтора, которые интенсивно реагируют практически со всеми органическими растворителями). CS2, C2H5OH, C2H5OC2H5, CHCl3, CCl4, C6H6, бензине – “подобное растворяется в подобном”. Для растворения хлора можно использовать CCl4. Йод также хорошо растворим в растворах иодидов металлов за счет образования комплексного иона I3-. Это свойство позволяет легко экстрагировать галогены из водных растворов. Если, например, взболтать водный раствор йода с небольшим количеством CS2 (не смешивающегося с водой), то почти весь йод перейдет из воды в CS2, окрашивая его в фиолетовый цвет.
Особенностью галогенов является то, что растворение в воде процесс не только физический, но и химический:
H2O + Hal2 ↔ Hhal + HhalO, Hal = Cl, Br
В водном растворе галогены диспропорционируют – подробнее см. химические свойства галогенов.
Получение
Выделить вещество настолько активное, что норовит прореагировать со всем окружающим, не так просто.
Получение хлора
В промышленности хлор получают путем электролиза.
-
- Электролиз расплава хлорида натрия
- 2 NaCl → 2Na + Cl2
- К (-): Na+ + 1 e → Na0
- А (+): 2 Cl- — 1 e → Cl20
- Электролиз расплава хлорида натрия
- Электролиз раствора хлорида натрия
- 2NaCl + 2H2O → H2 + 2NaOH + Cl2
- К (-): 2H2O + 2 e → H20 + 2OH-
- А (+): 2Cl- — 1 e → Cl20
В лаборатории хлор получают при реакции соляной кислоты и сильных окислителей.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Фтор
Обычно получают из сложных солей. При интенсивном нагреве (термолиз) провоцируется распад на более простые и нужный газ.
Или электролизом KF*3HF. Аналогичный метод применяется в промышленности.
Получение йода
Йод получают с помощью окисления.
2KI + Cl2 → I2 + 2KCl
Получение брома
Бром получают с помощью окисления.
2HBr + Cl2 → Br2 + 2HCl
Применение
Химия прочно входит в нашу жизнь, внедряясь во все сферы. Человек научился применять галогены, а также его соединения на своё благо. Биологическое значение галогенов неоспоримо. Области применения их различны:
- медицина;
- фармакология;
- производство различных пластмасс, красителей и т. д.;
- сельское хозяйство.

Из природного соединение криолита, химическая формула которого выглядит следующим образом: Na3AlF6, получают алюминий. Соединения фтора нашли широкое распространение при производстве зубных паст. Фтор, как известно, служит для профилактики кариеса. Спиртовую настойку йода применяют для дезинфекции и обеззараживания ран.
Наиболее широкое применение в нашей жизни нашёл хлор. Область его применения довольно многообразна. Примеры использования:
- Производство пластмасс.
- Получение соляной кислоты.
- Производство синтетического волокна, растворителей, каучуков и др.
- Отбеливание тканей (льняных и хлопчатобумажных), бумаги.
- Обеззараживание питьевой воды. Но всё чаще для этой цели используется озон, так как применение хлора вредно для организма человека.
- Дезинфекция помещений
Нужно помнить, что галогены — очень токсичные вещества. Особенно ярко это свойство выражено у фтора. Галогены могут оказывать удушающее и воздействие на органы дыхания и поражать биологические ткани.
Огромную опасность могут иметь пары хлора, а также аэрозоль фтора, имеющий слабый запах, он может ощутиться при большой концентрации. Человек может получить эффект удушья. При работе с такими соединениями нужно соблюдать меры предосторожности.
Методы производства галогенов сложные и многообразные. В промышленности к этому подходят с определёнными требованиями, соблюдение которых неукоснительно соблюдаются.
Биологическая роль галогенов
Все галогены обладают очень резким запахом. Вдыхание паров фтора, хлора и брома даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистых оболочек, а больших – удушение и тяжелое отравление. Жидкий бром, попадая на кожу, вызывает сильные ожоги и долго не заживающие язвы. В то же время, галогены необходимы для жизни.
Фтор важен для млекопитающих, в т.ч. и человека. Его соединения содержатся в костях и эмали зубов (0,01%). Колебания в содержании фтора в питьевой воде приводят к различным заболеваниям зубов. В то же время фтор и его соединения сильноядовиты, исключение составляют CF4, SF6 и некоторые другие химически инертные вещества.
Хлор существенно важен для многих форм жизни, включая человека. Ионы хлора в организме активируют некоторые ферменты, служат источником для образования соляной кислоты, создающей благоприятную среду для действия ферментов желудочного сока, влияют на электропроводность клеточных мембран и т.д. Соединения хлора содержатся в плазме крови и желудочном соке.
Необходим для поддержания жизни и хлорид натрия. Солевой обмен связан с водным балансом организма. Повышенное содержание хлорида натрия в организме удерживает воду в тканях.
Йод также важен для многих живых существ, в т.ч. и для человека. Соединения йода необходимы для нормальной работы щитовидной железы. Йод содержится не только в щитовидной железе, но и в надпочечниках. Гормон щитовидной железы тироксин (соединение йода) определяет общий темп процессов жизнедеятельности. Пары йода ядовиты.
Недостаток всех вышеперечисленных элементов приводит к серьезным заболеваниям.
Биологическая роль брома и астата не установлена. В небольших количествах соединения брома оказывают успокаивающее действие на центральную нервную систему. Бром очень токсичен, соединения брома, содержание анионы брома малотоксичны. Астат токсичен в силу своей радиоактивности.
Токсичность галогенов
Галогены в опасной концентрации и соединениях действуют на человека следующим образом:
- Хлор имеет 2 класс опасности. Концентрация в атмосфере от 1*10-4% уже вызывает раздражение слизистой, доза 0,01% приводит к острому отравлению и остановке дыхания. Это сильный канцероген, вызывающий туберкулёз и способствующий образованию злокачественных опухолей;
- Фтор в соединении фторида натрия – приводит к смерти, попадая внутрь через органы дыхания или пищеварения. Смертельная концентрация – 4-9 г. Первичные симптомы – слюнотечение, рвотные позывы. Вторичные признаки отравления – поражения нервной и сердечно-сосудистой систем.
- Бром вызывает спазмы и удушье при дыхании уже при концентрации 1*10-3 в объёме воздуха. Токсичная доза – 3 г., смертельная – от 34 г., при попадании внутрь человека.
- Йод, при случайном попадании в организм в количестве 3 г. и более, поражает почки и сердечно-сосудистую систему, блокирует рецепторы щитовидной железы.
Применение галогенов и галогенидов в промышленности и в быту приносит больше пользы, чем вреда. Знание допустимых значений концентрации и правил пользования продуктами, в которых применяются солероды, позволяет пользоваться только их положительными качествами.
- https://nauka.club/khimiya/galogeny.html
- https://obrazovanie.guru/himiya/chto-takoe-galogeny-himicheskie-svojstva-i-znachenie-galogenov.html
- https://ladle.ru/education/himia/8class/galogeny
- https://amperof.ru/teoriya/galogen-ximicheskie-i-fizicheskie-svojstva-gaza.html
- https://himgdz.ru/galogeni/fizicheskie-svoistva-galogenov/
- https://bingoschool.ru/manual/galogenyi-v-ximii-chto-eto-ix-xarakteristiki-i-svojstva-primeryi/
Ваша оценка?