Оба квантовомеханических подхода к описанию химической связи – ММО и МВС – приближенны, ММО придает преувеличенное значение делокализации электрона в молекуле и основывается на одноэлектронных волновых функциях – молекулярных орбиталях. МВС преувеличивает роль локализации электронной плотности и основывается на том, что элементарная связь осуществляется только парой электронов между двумя атомами.
Сравнивая МВС м ММО, следует отметить, что достоинством первого является его наглядность: насыщаемость связи объясняется как максимальная ковалентность, направленность вытекает из направленности атомных и гибридных орбиталей; дипольный момент молекулы складывается из дипольных моментов связей, разности ОЭО атомов, образующих молекулу, и наличия неподеленных электронных пар.
Однако существование некоторых соединений невозможно объяснить с позиций МВС. Это электронодефицитные соединения (B2H6, NO, 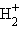 ) и соединения благородных газов. Их строение легко объясняет ММО. Устойчивость молекулярных ионов и атомов в сравнении с молекулами легко предсказывается с позиции ММО. И, наконец, магнетизм и окраска вещества также легко объясняются ММО.
) и соединения благородных газов. Их строение легко объясняет ММО. Устойчивость молекулярных ионов и атомов в сравнении с молекулами легко предсказывается с позиции ММО. И, наконец, магнетизм и окраска вещества также легко объясняются ММО.
Количественные расчеты в ММО, несмотря на свою громоздкость, все же гораздо проще, чем в МВС. Поэтому в настоящее время в квантовой химии МВС почти не применяется. В то же время качественно выводы МВС гораздо нагляднее и шире используются экспериментаторами, чем ММО. Основанием для этого служит тот факт, что реально в молекуле вероятность пребывания данного электрона между связанными атомами гораздо больше, чем на других атомах, хотя и там она не равна нулю. В конечном счете, выбор метода определяется объектом исследования и поставленной задачей.
Ваша оценка?








