Ионы, находящиеся во внешней сфере комплексных соединений, связаны с комплексным ионом в основном силами электростатического взаимодействия. Комплексное соединение при электролитической диссоциации образуют комплексные ионы и ионы внешней сферы как сильные электролиты, например:
Na2[Ni(CN)4] ® 2Na+ + [Ni(CN)4]2–
[Ni(NH3)6]SO4 ® [Ni(NH3)6]2+ + SO42–
Комплексные соединения могут быть неэлектролитами. Например, [PtCl2(NH3)2] – неэлектролит, так как содержит только внутреннюю сферу.
Комплексные ионы подвергаются диссоциации как слабые электролиты. Упрощенно диссоциацию внутренней сферы можно представить таким образом:
[Ni(NH3)6]2+ « Ni2+ + 6NH3
[Ni(CN)4]2– « Ni2+ + 4CN–
Применяя закон действующих масс к обратимым процессам диссоциации комплексных ионов, получим выражения константы нестойкости комплексов:
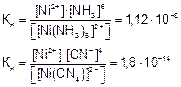
Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного иона. Чем меньше константа нестойкости, тем прочнее комплексный ион.
Комплекс [Ni(CN)4]2– прочнее, чем [Ni(NH3)6]2+, так как
1,8•10–14<1,12•10–8.
К комплексным соединениям близко примыкают двойные соли, т.е. соединения с малоустойчивой внутренней сферой. Например, KAl(SO4)2.
Двойные соли в отличие от комплексных соединений диссоциируют на все составляющие их ионы:
KAl(SO4)2 « K+ + Al3+ + 2SO42–
Пример. Напишите молекулярные и ионно-молекулярные уравнения получения комплексных соединений, полученных при взаимодействии раствора ZnSO4 с избытком растворов NH4OH и NaCN.
Решение. Определяем комплексообразователь и его степень окисления: Zn2+.
Лиганды: CN– и NH3(NH4OH « NH3 + H2O).
Координационное число Zn2+ равно четырем.
Составляем внутреннюю координационную сферу и определяем ее заряд, который равен алгебраической сумме зарядов, образующих его простых ионов (нейтральные молекулы NH3 не влияют на заряд). Внутреннюю сферу заключаем в квадратные скобки:
[Zn(NH3)4]2+ — комплексный катион;
[Zn(CN)4]2– — комплексный анион.
Определяем ионы внешней координационной сферы:
SO42– и Na+
Составляем формулы комплексных соединений:
[Zn(NH3)4]SO4 и Na2[Zn(CN)4]
Молекулярное уравнение получения [Zn(NH3)4]SO4:
ZnSO4 + 4NH4OH = [Zn(NH3)4]SO4 + 4H2O
Ионно-молекулярное уравнение:
Zn2+ + 4NH4OH = [Zn(NH3)4]2+ + 4H2O
Молекулярное уравнение получения Na2[Zn(CN)4]:
ZnSO4 + 4NaCN = Na2[Zn(CN)4] + Na2SO4
Ионно-молекулярное уравнение:
Zn2+ + 4CN– = [Zn(CN)4]2–
Пример. Определите заряд комплексного иона, координационное число и степень окисления комплексообразователя в соединениях:
K2[Sn(OH)4]; [Cr(H2O)4Cl2]Cl
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число равно числу лигандов, координированных вокруг комплексообразователя. Степень окисления комплексообразователя определяется из того, что алгебраическая сумма степеней окисления всех атомов и молекул в соединении равна нулю. Заряды нейтральных молекул равны нулю.
| Комплексное соединение | Заряд комплексного иона | Координационное число | Степень окисления комплексообразователя |
| K2[Sn(OH)4] [Cr(H2O)4Cl2]Cl | [Sn(OH)4]2– [Cr(H2O)4Cl2]+ | 4 6 | Sn+2 Cr+3 |
Ваша оценка?







