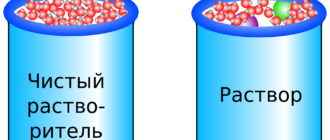
Если раствор и растворитель разделены полупроницаемой (т.е. проницаемой только для растворителя) мембраной, то растворитель проникает в раствор, преодолевая избыточное давление, до достижения равновесного его значения – осмотического давления.
Осмотическое давление не зависит от природы растворителя и растворенного вещества, оно пропорционально молярной концентрации раствора СМ и абсолютной температуре Т:
р осм = СМ ×R×T,
где R – универсальная газовая постоянная. Подставляя в это выражение СМ=n/V, где n – химическое количество растворенного вещества, моль; V – объем раствора , л, получаем уравнение, аналогичное уравнению газового состояния:
росм×V = n×R×T.
Закон Вант-Гоффа: осмотическое давление численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объем равный объему расвтора.
При определении молярной массы растворенного вещества по величине осмотического давления используют соотношение:
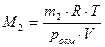 ,
,
где m2 масса растворенного вещества, г; V – объем раствора, л.
1 Электроотрицательность – условная величина, характеризующая способность атома в химическом соединении притягивать к себе электроны.
Ваша оценка?