- Общее описание
- Исторические сведения
- Физические свойства
- Химические свойства
- Взаимодействие азотной кислоты с простыми веществами:
- Взаимодействие азотной кислоты со сложными веществами:
- Промышленное производство, применение и действие на организм
- Производство азотной кислоты
- Сырье для выпуска азотной кислоты
- Применение катализаторов при выпуске азотной кислоты
- Где применяется азотная кислота?
- Основные проблемы в производстве азотной кислоты
- Действие на организм
- Перспективы развития азотнокислотного производства
Общее описание
Формула азотной кислоты HNO3. Это сильная бесцветная кислота с резким запахом. Она неограниченно растворима в воде. Имеет небольшие температуры плавления (-41°C) и кипения (82,6°С). Плотность кислоты – 1,52 г/см3.

Рис. 1. Азотная кислота.
Концентрированная азотная кислота выделяет ядовитые газы – оксиды азота. Азотная кислота окисляет органические вещества: разрушает бумагу, натуральную ткань, вызывает ожоги на коже.
Азотная кислота в небольшом количестве образуется в дождевой воде при разрядах молнии.
Исторические сведения
Методика получения разбавленной азотной кислоты путём сухой перегонки селитры с квасцами и медным купоросом была, по видимому, впервые описана в трактатах Джабира (Гебера в латинизированных переводах) в VIII веке. Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса железным, применялся в европейской и арабской алхимии вплоть до XVII века.
В XVII веке Глаубер предложил метод получения летучих кислот реакцией их солей с концентрированной серной кислотой, в том числе и азотной кислоты из калийной селитры, что позволило ввести в химическую практику концентрированную азотную кислоту и изучить её свойства. Метод Глаубера применялся до начала XX века, причём единственной существенной модификацией его оказалась замена калийной селитры на более дешёвую натриевую (чилийскую) селитру.
Во времена М. В. Ломоносова азотную кислоту называли крепкой водкой.
Физические свойства
Чистая азотная кислота не имеет цвета, обладает резким запахом, а на воздухе имеет особенность “дымиться”. Молярная масса составляет 63 г/моль. При температуре -42 градуса переходит в твердое агрегатное состояние и превращается в белоснежную массу. Безводная азотная кислота закипает при 86 градусах. В процессе смешивания с водой образует растворы отличные друг от друга по концентрации.
Данное вещество является одноосновной, то есть всегда имеет одну карбоксильную группу. Среди кислот, которые относятся к мощным окислителями, азотная кислота является одной из сильнейших. Она вступает в реакцию со многими металлами и неметаллами, органическими соединениями за счет восстановления азота
Нитраты – соли азотной кислоты. Чаще всего их используют в качестве удобрений в сельском хозяйстве
Химические свойства
Электронную и структурную формулу азотной кислоты изображают следующим образом:

Рис. 1. Электронная формула азотной кислоты.
Концентрированная азотная кислота подвержена воздействию света и под его действием способна разлагаться на оксиды азота. Оксиды, в свою очередь, взаимодействуя с кислотой, растворяются в ней и придают жидкости желтоватый оттенок:
4HNO3=4NO2+O2+2H2O
Хранить вещество следует в прохладном и темном месте. При повышении ее температуры и концентрации процесс распада происходит значительно быстрее. Азот в молекуле азотной кислоты всегда имеет валентность IV, степень окисления +5, координационное число 3.
Так как азотная кислота является очень сильной кислотой, в растворах она полностью разлагается на ионы. Она реагирует с основными оксидами, с основаниями, с солями более слабых и более летучих кислот.
Эта одноосновная кислота – сильнейший окислитель. Азотная кислота действует на многие металлы. В зависимости от концентрации, активности металла и условий проведения реакции может восстанавливаться с одновременным образованием соли азотной кислоты (нитрата) до соединений.
Когда азотная кислота взаимодействует с малоактивными металлами образуется NO2:
Cu+4HNO3 (конц.)=Сu(NO3)2 +2NO2+2H2O
Разбавленная азотная кислота в такой ситуации восстанавливается до NO:
3Cu+8HNO3(разб.)=3Сu(NO3)2 +2NO+4H2O
Если в реакцию с разбавленной азотной кислотой вступают более активные металлы, то выделяется NO2:
4Mg+10HNO3 (разб.)=4Mg(NO3)2+N2O+5H2O
Очень разбавленная азотная кислота при взаимодействии с активными металлами восстанавливается до солей аммония:
4Zn+10HNO3 (очень разб.)=4Zn(NO3)2+NH4NO3+3H2O
В концентрированной азотной кислоте устойчивы Au, Pt, Rh, Ir, Ta, Ti. Металлы Al, Fe, Cr она «пассивирует» в результате образования на поверхности металлов оксидных пленок.
Смесь, образованная из одного объема концентрированной азотной и трех объемов концентрированной хлороводородной (соляной) кислоты называется «царской водкой».

Рис. 3. Царская водка.
Неметаллы окисляются азотной кислотой до соответствующих кислот, а азотная кислота в зависимости от концентрации восстанавливается до NO или NO2:
С+4HNO3 (конц.)=CO2+4NO2+2H2OS+6HNO3 (конц.)=H2SO4+6NO2+2H2O
Азотная кислота способна окислять некоторые катионы и анионы, а также неорганические ковалентные соединения, например, сероводород.
3H2S+8HNO3 (разб.)= 3H2SO4 +8NO+4H2O
Азотная кислота взаимодействует со многими органическими веществами, при этом один или несколько атомов водорода в молекуле органического вещества заменяются нитрогруппами – NO2. Этот процесс называется нитрованием.
Взаимодействие азотной кислоты с простыми веществами:
1) с металлами — сильными восстановителями:
10HNO3(оч. разб.) + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3(разб.) + 4Mg → 4Mg(NO3)2 + N2O + 5H2O (возможно образование N2)
2) с металлами — слабыми восстановителями:
8HNO3(разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
4HNO3(конц.) + 3Cu → 3Cu(NO3)2 + 2NO2 + 2H2O
HNO3(конц.) + Fe → Fe(NO3)3 + NO2 + H2O
3) С неметаллами (слабыми восстановителями) образуются соответствующие кислоты, а также NO (если кислота разб.) или NO2 (если кислота конц.):
10HNO3(конц.) + I2 → 2HIO3 + 10NO2 + 4H2O (t) (из галогенов реакция идет только с йодом)
4HNO3(конц.) + C → CO2 + 4NO2 + 2H2O
5HNO3(конц.) + P → H3PO4 + 5NO2 + H2O
6HNO3(конц.) + S → H2SO4 + 6NO2 + 2H2O
Взаимодействие азотной кислоты со сложными веществами:
Окисляем анион:
8HNO3(к) + H2S → H2SO4 + 8NO2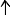
+ 4H2O
8HNO3(к) + Na2S → Na2SO4 + 8NO2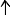
+ 4H2O
4HNO3(конц.) + CuS → Cu(NO3)2 + S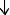
+ 2NO2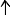
+ 2H2O
8HNO3(конц.) + CuS → CuSO4 + 8NO2 + 4H2O
8HNO3 + Cu2S → 2Cu(NO3)2 + S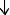
+ 4NO2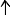
+ 4H2O
12HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + 10NO2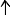
+ 6H2O
16HNO3(к) + Mg3P2 → Mg3(PO4)2 + 16NO2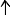
+ 8H2O
16HNO3(к) + Ca(HS)2 → H2SO4 + CaSO4 + 16NO2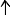
+ 8H2O
8HNO3(к) + AlP → AlPO4 + 8NO2 + 4H2O
В избытке кислоты фосфаты растворяются:
11HNO3(к, изб.) + AlP → H3PO4 + Al(NO3)3 + 8NO2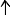
+ 4H2O
Окисляем металл соли или оксида:
10HNO3(к) + Fe3O4 → 3Fe(NO3)3 + NO2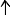
+ 5H2O
4HNO3(к) + FeO → Fe(NO3)3 + NO2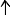
+ 2H2O
HNO3(к) + FeSO4 → Fe(NO3)3 + NO2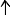
+ H2SO4 + H2O
4HNO3(к) + CrCl2 → Cr(NO3)3 + NO2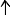
+ 2HCl + H2O (ионы Cl– азотная кислота окислить не может)
Одновременное окисление катиона и аниона:
14HNO3(к) + Cu2S → H2SO4 + 2Cu(NO3)2 + 10NO2
+ 6H2O.
Промышленное производство, применение и действие на организм
Перевозка азотной кислоты железнодорожным транспортом осуществляется в специализированных вагонах-цистернах
Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности.
Производство азотной кислоты
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
4NH3 + 5O2 →Pt 4NO + 6H2O 2NO + O2 → 2NO24NO2 + O2 + 2H2O → 4HNO3
Все три реакции — экзотермические, первая — необратимая, остальные — обратимые. Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Для получения концентрированной азотной кислоты либо смещают равновесие в третьей реакции путём повышения давления до 50 атмосфер, либо в разбавленную азотную кислоту добавляют серную кислоту и нагревают, при этом азотная кислота, в отличие от воды и серной кислоты, испаряется.
Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
4KNO3 + 2FeSO4 ⋅ 7H2O →ot Fe2O3 + 2K2SO4 + 2HNO3↑ + 2NO2↑ + 6H2O
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
KNO3 + H2SO4 →ot KHSO4 + HNO3↑
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Сырье для выпуска азотной кислоты
Итак, основное сырье, используемое в производстве рассматриваемого вещества — это аммиак, воздух, а также вода.
При этом требуется применение аммиака в очищенном виде. Для этого он в рамках различных производственных циклов очищается на специальном испарительном и дистилляционном оборудовании. Аналогично при выпуске азотной кислоты должен применяться и чистый воздух. Он также фильтруется с применением специального оборудования. В свою очередь, вода, которая используется при выпуске азотной кислоты, очищается от примесей и солей. Во многих случаях для получения рассматриваемого вещества необходимо задействовать чистый конденсат.
Изучим то, в каких разновидностях рассматриваемое вещество может быть представлено, а также то, каким образом производится каждый тип азотной кислоты.
Применение катализаторов при выпуске азотной кислоты
Полезно будет рассмотреть то, какие еще вещества применяются наряду с основным сырьем для выпуска рассматриваемого продукта в промышленном (чаще всего в качестве таковых рассматриваются катализаторы) производстве азотной кислоты. Использование веществ, о которых идет речь, обусловлено необходимостью увеличения рентабельности выпуска кислоты, повышение динамики ее выхода на промышленном агрегате.
Главное требование к катализатору при производстве рассматриваемого продукта — избирательность действия. То есть он должен воздействовать на основную химическую реакцию, не затрагивая побочные процессы. Чаще всего в производстве кислоты задействуются катализаторы, в составе которых присутствует платина.
Выше мы отметили, что при выпуске слабоконцентрированного вещества при повышенном давлении задействуются катализаторы на основе платины и родия. В ряде случаев также применяются сплавы с добавлением палладия. Но основной металл в них — платина, ее содержание обычно составляет не менее 81%. Сущность катализатора в данном случае — стимулировать быстрое прохождение основной химической реакции. Как правило, она проходит в рамках внешнедиффузионного участка.
При этом процесс зависит от пределов диффузии кислорода относительно поверхности катализатора. Данная особенность обуславливает более высокую концентрацию аммиака — основного сырья для выпуска азотной кислоты, на поверхности того или иногда катализатора, если сравнивать соответствующий показатель с концентрацией на воздухе. Возможно увеличение удельного веса различных побочных реакций, при которых наблюдается неполное окисление и образование азота либо его оксида. В связи с этим кислород у поверхности должен находиться в количестве, достаточном для вытеснения аммиака. В этом случае удастся достичь достаточно глубокого окисления.
Можно отметить, что, наряду с платиновыми катализаторами, в производстве азотной кислоты также задействуются комбинированные вещества. В частности, железохромовые. Они позволяют существенно снизить экономические издержки, характеризующие выпуск рассматриваемого вещества.
Итак, мы рассмотрели способы производства азотной кислоты, выделили основные ее типы. То, сколько стадий производства азотной кислоты необходимо реализовать, зависит от ее разновидности, а также конкретной технологии выпуска соответствующего вещества. Полезно будет теперь рассмотреть то, какие сложности характеризуют промышленное производство данного востребованного во многих сферах экономики продукта.
Где применяется азотная кислота?
Этот реагент является одним из наиболее востребованных во многих отраслях промышленности. В частности, он используется для производства комбинированных и азотных удобрений (аммиачной, натриевой, калиевой и кальциевой селитры, нитрофоски, нитрофоса), взрывчатых веществ (тринитротолуола и пр.), ракетной техники, различных сернокислых солей и органических красителей.
В цветной и черной металлургии применяется для травления и растворения металлов, разделения серебра и золота. В органическом синтезе широко используют соединение серной и концентрированной азотной кислоты – «нитрующей смеси».
Также материал применяют для изготовления полупродуктов для получения искусственных красителей и других химикатов, в химической и полиграфической промышленностях. Он используется и при гальванизации, хромировании и никелировании деталей, в электротехнической и молочной отраслях.
Основные проблемы в производстве азотной кислоты
Итак, как мы уже знаем, производство азотной кислоты контактным способом — одним из самых распространенных в современной промышленности, предполагает задействование катализатора в целях ускорения окисления аммиака и увеличения выхода продукта. Основная проблема выпуска рассматриваемого продукта — достаточно высокая цена соответствующего катализатора. При этом его селективность не всегда достигает оптимальной величины. Кроме того, значительная часть платины, что используется в качестве основного элемента для катализатора, может теряться в ходе производства. В результате, опять же, снижается экономическая эффективность выпуска продукта.
Еще одна проблема, характеризующая производство азотной кислоты — экологическая. Выше мы отметили, что при концентрации сырья может использоваться серная кислота, и по факту прохождения соответствующего производственного цикла образуются вредные вещества. Альтернативой в данном случае может быть применение нитратов — но это, опять же, предполагает увеличение экономических издержек. Однако экологический фактор для современных производителей сегодня столь же значимый, как и уровень рентабельности производства.
Действие на организм
Азотная кислота ядовита. По степени воздействия на организм относится к веществам 3-го класса опасности. Её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При действии на кожу возникает характерное жёлтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (газа бурого цвета). ПДК для азотной кислоты в воздухе рабочей зоны по NO2 2 мг/м3. Рейтинг NFPA 704 для концентрированной азотной кислоты: опасность для здоровья: 4, огнеопасность: 0, нестабильность: 0, специальное: Ox
Перспективы развития азотнокислотного производства
Развитие азотнокислотного производств возможно в следующих основных направлениях:
- создание систем высокой единичной мощности (до 4000тыс.т/год), работающих по комбинированной схеме;
- разработка высокоактивных избирательных неплатиновых катализаторов окисления аммиака;
- более полное использование энергии сжатых отходящих газов и теплоты химических реакций – создание полностью автономных энергетических схем;
- создание замкнутого оборота охлаждающей воды;
- решение проблемы очистки отходящих газов с использованием в качестве адсорбента силикагеля и цеолитов;
- более полное удаление остатков оксидов азота из отходящих газов с использованием в качестве восстановителя природного газа и аммиака.
- https://obrazovaka.ru/himiya/poluchenie-azotnoy-kisloty.html
- https://chem.ru/azotnaja-kislota.html
- https://obrazovaka.ru/himiya/azotnaya-kislota-formula.html
- https://chemrise.ru/theory/nitric_acid_11
- https://FB.ru/article/259939/proizvodstvo-azotnoy-kislotyi-v-promyishlennosti-tehnologiya-stadii-osobennosti
- https://him-kazan.ru/stati/azotnaya-kislota
- http://dimkao.ru/poluchenie-kontsentrirovannoj-azotnoj-kisloty/
Ваша оценка?