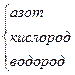Ранее было показано, что при образовании ковалентной связи электронные пары располагаются симметрично относительно ядер взаимодействующих атомов и атомы в молекулах никаких зарядов не несут.
При образовании ионных связей валентные электроны переходят от менее электроотрицательных (ЭО) к более электроотрицательным атомам, в результате чего образуются ионы, заряд которых определяется количеством отданных или присоединенных электронов. В молекулах с полярными связями валентные электроны лишь частично смещаются к более ЭО атому, при этом на взаимодействующих атомах возникают электрические заряды, но их величины не являются целочисленными. Например, в молекуле HCl на водороде существует положительный, а на Cl — отрицательный заряды, но их величины меньше 1.
В практических целях (при составлении уравнений окислительно-восстановительных реакций) заряды на атомах в молекулах с полярными связями удобно представлять в виде целых чисел, равных таким зарядам, которые возникли бы на атомах, если бы валентные электроны полностью переходили к более электроотрицательным атомам, т.е. если бы связи были полностью ионными. Такие величины зарядов получили название степеней окисления. Степень окисления любого элемента в простом веществе всегда равна 0.
В молекулах сложных веществ некоторые элементы всегда имеют постоянную степень окисления. Для большинства элементов характерны переменные степени окисления, различающиеся как знаком, так и величиной, в зависимости от состава молекулы.
У щелочных металлов, а также у металлов главной подгруппы второй группы степень окисления во всех соединениях равна соответственно +1 и +2. Постоянную степень окисления, равную -1, имеет фтор. Кислород, как правило, имеет степень окисления -2. У водорода в соединениях с неметаллами степень окисления +1, в гидридах металлов — -1. Для того, чтобы отличить значения степени окисления от зарядов ионов в первом случае знак ставится перед цифрой, во втором — после цифры. Например, Н+1Cl-1, но Na1+Cl1-.
Часто степень окисления (СО) равна валентности и отличается от нее только знаком. Но встречаются соединения, в которых степень окисления элемента не равна его валентности. Как уже отмечалось, в простых веществах СО элемента всегда равна нулю независимо от его валентности. В таблице сопоставлены валентности и степени окисления некоторых элементов в различных соединениях.
| соединение | элемент | валентность | схема | степень окисления |
| О2 | кислород | 2 | О=О | |
| Н2О |
| 2 1 |
Н Н | -2 +1 |
| Н2О2 |
| 2 1 | Н→О – О←Н | -1 +1 |
| N2 | азот | 3 | N≡N | |
| NH3 |
| 3 1 | H N H H | -3 +1 |
|
|
| 3 1 | F N F F | +3 -1 |
|
|
| 3 1 | H H N—N H H | -2 +1 |
|
|
| 3 2 1 | H N O H H | -1 -2 +1 |
Определение степени окисления элемента в какой либо молекуле сводится к простой арифметической операции, так как сумма степеней окисления атомов всех элементов, входящих в состав молекулы, равна нулю. Например, необходимо определить степень окисления фосфора в фосфорной кислоте Н3РО4. Поскольку у кислорода СО – -2 , а у водорода — +1, то для нулевой суммы у фосфора степень окисления должна быть равна 5:
[3(+1)+1(+5)+4(-2)=0].
Ваша оценка?


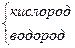

 О
О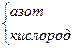

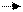
 NF3
NF3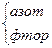



 N2H4 (гидразин)
N2H4 (гидразин)

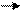

 NH2OH (гидроксил-амин)
NH2OH (гидроксил-амин)