- Что из себя представляет серная кислота
- Физические и физико-химические свойства
- Олеум
- Химические свойства
- Получение
- Нитрозный (башенный) способ
- Промышленное производство серной кислоты (контактный способ):
- Другой способ
- Применение
- Применение серной кислоты в промышленности
- Применение серной кислоты в быту
- Применение серной кислоты в медицине
- Применение серной кислоты в производстве
- Опасность для здоровья
- Факты о серной кислоте
- Дополнительные сведения
Что из себя представляет серная кислота
Серная кислота является сильной кислотой, двухосновной, устойчивой и нелетучей.
В стандартных условиях серная кислота представляет собой тяжелую маслянистую жидкость. Вещество отличается хорошей растворимостью в воде.
H2SO4
Молекула серной кислоты включает в себя:
- четыре атома кислорода;
- два атома водорода;
- один атом серы.
Жидкость токсична, не имеет запаха. Кислота в чистом состоянии бесцветная, обладает специфическим «медным» привкусом, плотность составляет 1,84 г/см3. Из-за примесей вещество приобретает желтоватую или буро-желтую окраску. В зависимости от концентрации различают:
- разбавленную H2SO4 в виде водного раствора с процентным содержанием H2SO4 не более 70%;
- концентрированную H2SO4 в виде водного раствора с концентрацией H2SO4 более 70%.
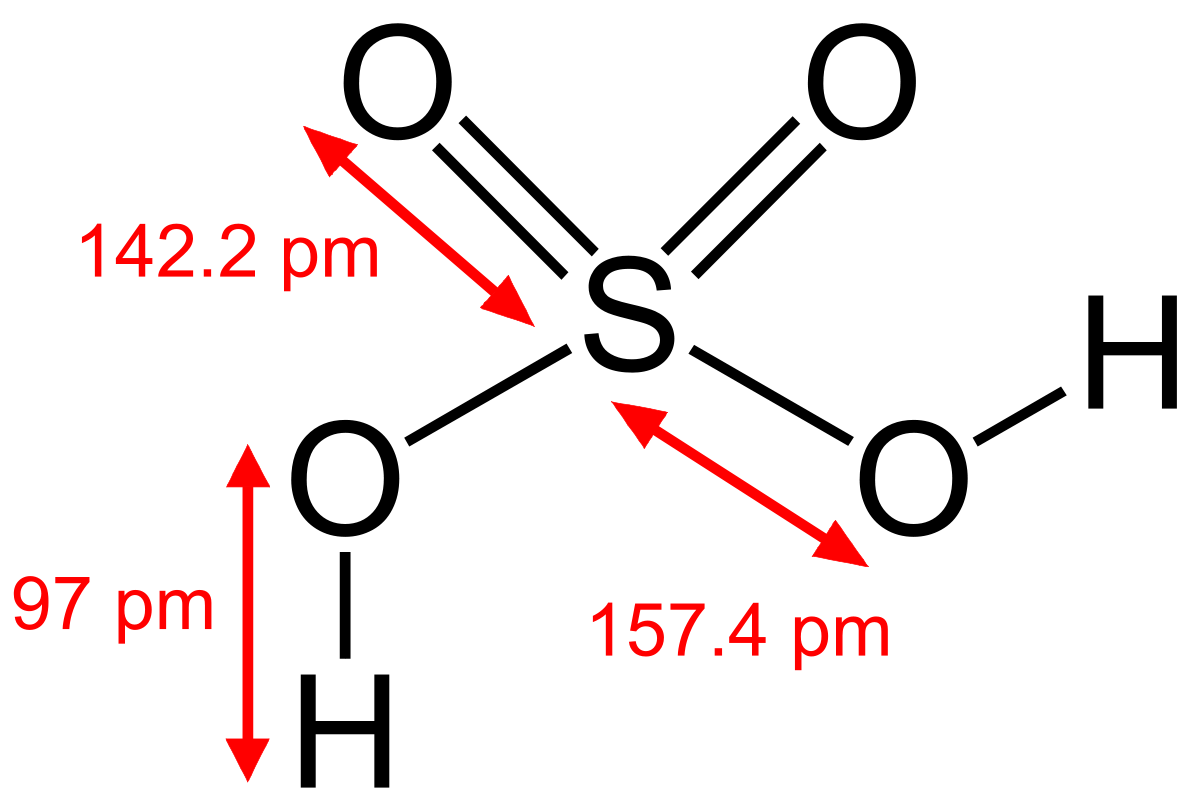
Молекула серной кислоты обладает формой, близкой к тетраэдрической (атом серы располагается в центре, атомы кислорода — в вершинах тетраэдра

Физические и физико-химические свойства
Очень сильная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2O с температурой кипения 338,8оС). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, HSO4− — 0,18, H3SO4+ — 0,14, H3O+ — 0,09, H2S2O7, — 0,04, HS2O7⁻ — 0,05. Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H3O+, HSO3+, и 2HSO₄−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
H2SO4 + SO3 → H2S2O7 Сульфит
H2SO4 + 2SO3 → H2S3O10
Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H2SO4.
Свойства водных растворов серной кислоты и олеума Содержание % по массеПлотность при 20 ℃, г/см³Температура плавления, ℃Температура кипения, ℃H2SO4SO3 (свободный)
| 10 | — | 1,0661 | −5,5 | 102,0 |
| 20 | — | 1,1394 | −19,0 | 104,4 |
| 40 | — | 1,3028 | −65,2 | 113,9 |
| 60 | — | 1,4983 | −25,8 | 141,8 |
| 80 | — | 1,7272 | −3,0 | 210,2 |
| 98 | — | 1,8365 | 0,1 | 332,4 |
| 100 | — | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
lg p = A − B + 2,126 , T
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
H2SO4 ⟷ H2O + SO3 − Q .
При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
d = 1,851 7 − 1,1 ⋅ 10−3 t + 2 ⋅ 10−6 t2
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
λ = 0,518 + 0,0016t − ( 0,25 + t/1293 ) ⋅ C/100
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H2SO4·SO3, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO3 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H2SO4. Для олеума минимальное ρ при концентрации 10 % SO3. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
Химические свойства
Серная кислота – это сильная двухосновная кислота.
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
H2SO4 ⇄ H+ + HSO4–
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4– ⇄ H+ + SO42–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, серная кислота взаимодействует с оксидом магния:
H2SO4 + MgO → MgSO4 + H2O
Еще пример: при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
H2SO4 + КОН → KHSО4 + H2O
H2SO4 + 2КОН → К2SО4 + 2H2O
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например, серная кислота взаимодействует с гидрокарбонатом натрия:
Н2SO4 + 2NaHCO3 → Na2SO4 + CO2 + H2O
Или с силикатом натрия:
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
NaNO3(тв.) + H2SO4 → NaHSO4 + HNO3
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например, хлорида натрия:
NaCl(тв.) + H2SO4 → NaHSO4 + HCl
4. Также серная кислота вступает в обменные реакции с солями.
Например, серная кислота взаимодействует с хлоридом бария:
H2SO4 + BaCl2 → BaSO4 + 2HCl
5.Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, серная кислота реагирует с железом. При этом образуется сульфат железа (II):
H2SO4(разб.) + Fe → FeSO4 + H2
Серная кислота взаимодействует с аммиакомс образованием солей аммония:
H2SO4 + NH3 → NH4HSO4
Концентрированнаясерная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
6H2SO4(конц.) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2Al → Al2(SO4)3 + 3SO2 + 6H2O
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H2SO4(конц.) + Cu → CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + Hg → HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag → Ag2SO4 + SO2↑+ 2H2O
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H2SO4(конц.) + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видеоопытвзаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7.Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например, концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
5H2SO4(конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С → СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S → 3SO2 ↑ + 2H2O
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) + 2KBr → Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц.) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S → 4S↓ + 4H2O
Получение
Нитрозный (башенный) способ
Раньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли башенной (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды. Именно таким способом произошла реакция в воздухе Лондона во время Великого смога.
SO2 + NO2 + H2O = H2SO4 + NO ↑
Промышленное производство серной кислоты (контактный способ):

1) 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2) 2SO2 + O2V2O5→ 2SO3
3) nSO3 + H2SO4 → H2SO4·nSO3 (олеум)
Измельчённый очищенный влажный пирит (серный колчедан) сверху засыпают в печь для обжига в «кипящем слое«. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом.
Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный) и мельчайшие частицы огарка (оксида железа). Газ очищают от примесей твёрдых частиц (в циклоне и электрофильтре) и паров воды (в сушильной башне).
В контактном аппарате происходит окисление сернистого газа с использованием катализатора V2O5 ( пятиокись ванадия) для увеличения скорости реакции. Процесс окисления одного оксида в другой является обратимым. Поэтому подбирают оптимальные условия протекания прямой реакции — повышенное давление (т.к прямая реакция идет с уменьшением общего объема) и температура не выше 500 С ( т.к реакция экзотермическая).
В поглотительной башне происходит поглощение оксида серы (VI) концентрированной серной кислотой.
Поглощение водой не используют, т.к оксид серы растворяется в воде с выделением большого количества теплоты, поэтому образующаяся серная кислота закипает и превращается в пар. Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3
Другой способ
В тех редких случаях, когда сероводород (H2S) вытесняет сульфат(SO4-) из соли (с металлами Cu,Ag,Pb,Hg) побочным продуктом является серная кислота
H2S + CuSO4 = CuS + H2SO4
Сульфиды данных металлов обладают высочайшей прочностью, а также отличительным чёрным окрасом,
но могут быть окислены до сульфатов, например, азотной кислотой при кипении:
CuS + 8HNO3 → CuSO4 + 8NO2↑ + 4H2O
Применение
Применение серной кислоты в промышленности
Пищевая промышленность знакома с серной кислотой в виде пищевой добавки Е513. Кислота выступает в качестве эмульгатора. Данная пищевая добавка используется для изготовления напитков. С её помощью регулируется кислотность. Помимо пищи, Е513 входит в состав минеральных удобрений. Применение серной кислоты в промышленности имеет широкое распространение. Промышленный органический синтез использует серную кислоту для проведения следующих реакций: алкилирование, дегидратация, гидратация. С помощью данной кислоты восстанавливается необходимое количество смол на фильтрах, что используются на производстве дистилированной воды.
Применение серной кислоты в быту
Серная кислота в домашних условиях пользуется спросом среди автолюбителей. Процесс приготовления раствора электролита для автомобильного аккумулятора сопровождается добавление серной кислоты. Работая с данной кислотой следует помнить о правилах безопасности. В случае попадания кислоты на одежду или открытые участки кожи, стоит немедленно промыть их проточной водой. Серная кислота, которая разлилась на металл, может нейтрализоваться с помощью извести или мела. Заправляя автомобильный аккумулятор необходимо придерживаться некой последовательности: постепенно добавлять кислоту к воде, а не наоборот. Когда вода вступает в реакцию с серной кислотой происходит сильное нагревание жидкости, что может приводить к её разбрызгиванию. Поэтому стоит быть особо внимательным, чтобы жидкость не попала на лицо, или в глаза. Кислота должна храниться в плотно закрытой емкости. Важно, чтобы химическое вещество сохранялось в недоступном для детей месте.
Применение серной кислоты в медицине
В медицине нашлось широкое применение солей серной кислоты. К примеру, магний сульфат назначается людям с целью достичь слабительного эффекта. Еще одним производным серной кислоты есть натрий тиосульфат. Лекарственное средство используется в роли противоядия в случае отправления следующими веществами: ртуть, свинец, галогены, цианид. Тиосульфат натрий вместе с соляной кислотой используется для лечения дерматологических заболеваний. Профессор Демьянович предложил союз этих двух препаратов для лечения чесотки. В виде водного раствора, натрий тиосульфат вводят людям, которые страдают аллергическими недугами.
Магния сульфат обладает широким спектром возможностей. Поэтому применяется врачами различных специальностей. В качестве спазмолитика магний сульфат вводят больным при гипертонической болезни. Если у человека присутствуют заболевания желчного пузыря, вещество вводится внутрь для улучшение желчеотделения. Применение серной кислоты в медицине в виде магния сульфата в гинекологической практике встречается часто. Гинекологи помогают роженицам посредством введения магния сульфата внутримышечно, таким способом они обезболивают роды. Помимо всех выше указанных свойств, магний сульфат обладает антисудорожным эффектом.
Применение серной кислоты в производстве
Серная кислота, области применение которой разнообразны, используется так же при производстве минеральных удобрений. Для более удобного сотрудничества, заводы,что занимаются производством серной кислоты и минеральных удобрений, в основном, расположены поблизости друг от друга. Этот момент создает непрерывное производство.
Применение серной кислоты в изготовлении красителей и синтетических волокон занимает второе место по распространенности после производства минеральных удобрений. Многие отрасли промышленности используют серную кислоту в некоторых процессах на производстве. Применение серной кислоты нашло спрос и в быту. Люди пользуются химическим веществом для обслуживания своих автомобилей. Приобрести серную кислоту возможно в магазинах, что имеют специализацию по продаже химических веществ, в том числе у нас по ссылке. Серная кислота транспортируется соответственно правилам перевозки подобного груза. Железнодорожный или автомобильный транспорт перевозит кислоту в соответствующих емкостях. В первом случае в качестве емкости выступает цистерна, во втором – бочка или контейнер.
Опасность для здоровья
Пары этой кислоты крайне токсичны и при вдыхании могут привести к серьезному повреждению легких.
Попадание в глаза вызывает полную потерю зрения, а на кожу — серьезные ожоги.
При приеме внутрь (даже если это капля) — может привести к мучительной смерти.
Обращение с серной кислотой должно осуществляться с большой осторожностью и в соответствии с мерами промышленной безопасности.
Факты о серной кислоте
Вот некоторые факты о серной кислоте, которые дадут вам дополнительное представление об этой едкой, опасной, но важной кислоте.
Молярная масса серной кислоты составляет 98,08 г / моль. Это рассчитывается в соответствии с атомными массами его атомов: два атома водорода (2 х 1,008 г / моль), один атом серы (1 х 32,065 г / моль) и четыре атома кислорода (4 х 16 г / моль). Для общего веса одной молекулы серной кислоты расчет такой же, но результаты приведены в аму или единицах атомной массы. Именно когда вы хотите знать молекулярную массу более чем одного моля, результат молекулярной массы отличается от молярной массы. Например, когда у вас есть 2 грамма диоксида серы (SO2 с молярной массой 64,065 г / моль) и вы хотите знать, сколько это молей. Чтобы рассчитать этот результат, сначала нужно разделить 1 (моль) с молярной массой вещества. Затем вы умножаете результат на 2 (граммы), как показано в приведенном ниже уравнении.

Плотность серной кислоты зависит от ее силы (концентрации) и температуры. Например, 13% раствор H2SO4 при комнатной температуре имеет плотность 9,09 г / см3. 96% раствор при той же температуре имеет плотность 15,37 г / см3. Температура кипения серной кислоты составляет 639 ° F, 337 ° C или 610 К; температура замерзания составляет 37 ° F, а температура плавления – 50 ° F.
Дополнительные сведения
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (Полуостров Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3⋅107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994.
- https://wika.tutoronline.ru/himiya/class/9/soedineniya-sernoj-kisloty-i-eyo-primeneniya
- https://chem.ru/sernaja-kislota.html
- https://chemege.ru/sernaya-kislota/
- https://bigenc.ru/chemistry/text/3658765
- http://himege.ru/sernaya-kislota-ximicheskie-svojstva-i-promyshlennoe-proizvodstvo/
- http://himiya.gosstandart.info/slozhnye-veshchestva/kisloty/sernaya-kislota/
- https://snab365.ru/sulphuric-acid/
- https://fissi.ru/sulfuric-acid/
Ваша оценка?









