Химические реакции сопровождаются выделением или поглощением энергии. Если энергия выделяется или поглощается в виде теплоты, то такие реакции записываются посредством уравнений химической реакций с указанием тепловых эффектов, при этом необходимо указывать фазовый состав реагирующих веществ.
Химические реакции, протекающие с выделением тепла, называются экзотермическими, а с поглощением тепла – эндотермическими. Изучением тепловых эффектов реакций занимается термохимия. В термохимии тепловой эффект реакции обозначается Q и выражается в кДж. Термохимия составляет один из разделов химической термодинамики, изучающей переходы энергии из одной формы в другие и от одной совокупности тел к другим, а также возможность, направление и глубину осуществления химических и фазовых процессов в данных условиях. Каждое отдельное вещество или их совокупность представляет собой термодинамическую систему. Если термодинамическая система не обменивается с окружающей средой ни веществом, ни энергией, ее называют изолированной. Такая идеализированная система используется как физическая абстракция при рассмотрении процессов, исключающих влияние внешней среды. Система, обменивающаяся с окружающей средой только энергией, называется закрытой. Если же возможен энергетический и материальный обмен – система открытая.
Состояние системы определяется термодинамическими параметрами состояния – температурой, давлением, концентрацией, объемом и т.д. Система характеризуется, кроме того, такими свойствами как внутренняя энергия U, энтальпия H, энтропия S, энергия Гиббса G. Из изменение в ходе химических реакций характеризуют ее энергетику системы. Перечисленные свойства системы зависят от температуры, давления, концентрации, поэтому они называются функциями состояния, не зависят от пути процесса и определяются только конечным и начальным состояниеми системы.
Внутренняя энергия системы U складывается из энергии движения и взаимодействия молекул, энергии связи в молекулах, энергии движения и взаимодействия электронов и ядер и т. п.
Абсолютная величина внутренней энергии не может быть определена, но ее изменение при переходе системы из начального состояния в конечное в результате осуществления химического процесса поддается расчету. Если система получает некоторое количество тепла при постоянном давлении Qp, последнее расходуется на изменение внутренней энергии системы ΔU и совершение работы A = PΔV против внешних сил:
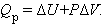
Это уравнение выражает закон сохранения энергии или первое начало термодинамики.
Адиабатический процесс – это процесс квазистатического расширения или сжатия газа в сосуде с теплонепроницаемыми стенками. Первый закон термодинамики для адиабатического процесса принимает вид
A = –ΔU.
Изотермический процесс – это процесс квазистатического расширения или сжатия вещества, находящегося в контакте с тепловым резервуаром, (T = const).
Так как внутренняя энергия идеального газа зависит только от температуры (закон Джоуля), то первый закон термодинамики для изотермического процесса записывается в виде: Q = A.
При изохорическом процессе (V = const) поглощение или выделение тепла (тепловой эффект) связано только с изменением внутренней энергии:
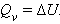
В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
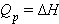
ΔH = ΔU + PΔV
Ваша оценка?









