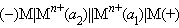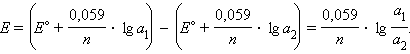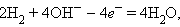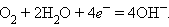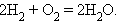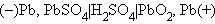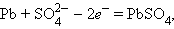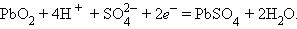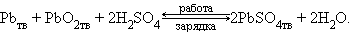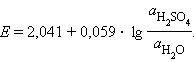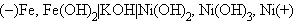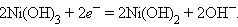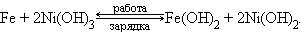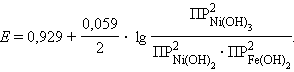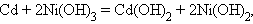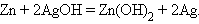Концентрационные элементы состоят из одинаковых электродов, отличающихся активностями потенциалопределяющего иона 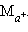 Действительно, из уравнения Нернста следует, что при
Действительно, из уравнения Нернста следует, что при 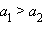 ЭДС концентрационного элемента
ЭДС концентрационного элемента
|
|
|
|
равна
|
|
|
|
ЭДС этих элементов обычно очень мала. Концентрационные элементы используются при определении pH и концентраций труднорастворимых солей.
В топливных гальванических элементах (электрохимических генераторах) процесс окисления некоторых видов топлива используется для непосредственного получения электрической энергии. Основным их преимуществом является принципиальная возможность достижения очень высоких КПД использования топлив.
В щелочном водородно-кислородном топливном элементе
|
|
|
|
где M1 и M2 – проводники первого рода, в основном серебро, металлы платиновой группы и некоторые другие, играющие роль катализаторов электродных процессов и токоотводов, на аноде идет реакция
|
|
|
|
а на катоде –
|
|
|
|
Суммарный процесс соответствует реакции горения водорода:
|
|
|
|
Батарея топливных элементов с устройствами для подвода топлива и окислителя, вывода продуктов реакции, поддержания и регулирования температуры, называется электрохимическим генератором. Кислородно-водородные генераторы применяются на космических кораблях. Они обеспечивают космический корабль и космонавтов не только энергией, но и водой, которая является продуктом реакции в топливном элементе.
Аккумуляторами называются обратимые гальванические элементы многоразового действия. При пропускании через них электрического тока (зарядке) они накапливают химическую энергию, которую потом при их работе (разрядке) отдают потребителю в виде электрической энергии. Наиболее распространены два вида аккумуляторов: кислотный (свинцовый) и щелочные.
Анод заряженного свинцового аккумулятора состоит из свинца, катод – из диоксида свинца. Металлический тип проводимости PbO2 делает его пригодным для работы в качестве электрода. Электролитом служит раствор H2SO4 (32–39 %), в котором PbSO4 и PbO2 малорастворимы.
Схему аккумулятора можно изобразить так:
|
|
|
|
Анодный процесс работающего аккумулятора
|
|
|
|
катодный процесс –
|
|
|
|
Таким образом, в свинцовом аккумуляторе осуществляется реакция
|
|
|
|
При зарядке протекает обратная реакция и электроды меняют свои функции: катод становится анодом, а анод – катодом. ЭДС свинцового аккумулятора зависит от отношения активности кислоты и воды:
|
|
|
|
В процессе работы аккумулятора концентрация кислоты падает, а следовательно, падает и ЭДС. Когда ЭДС достигает 1,85 В, аккумулятор считается разрядившимся. При более низкой ЭДС пластины покрываются тонким слоем PbSO4 и и аккумулятор разряжается необратимо. Во избежание этого аккумулятор периодически подзаряжают.
В заряженном щелочном железо-никелевом аккумуляторе анодом служит железо, катодом – гидроксид никеля (III), электролит – 20%-й раствор KOH:
|
|
|
|
При работе аккумулятора на аноде происходит окисление железа:
|
|
|
|
на катоде – восстановление гидроксида никеля (III):
|
|
|
|
Суммарная активность процесса:
|
|
|
|
В уравнении Нернста для данного аккумулятора под знаком логарифма стоят не концентрации, а произведения растворимости ПР участвующих в этой реакции труднорастворимых веществ:
|
|
|
|
ЭДС щелочного аккумулятора не зависит от концентрации щелочи, поскольку в выражение под знаком логарифма входят постоянные величины.
Аналогично работают щелочные кадмий-никелевый и серебряно-цинковый аккумуляторы:
|
|
|
|
|
|
|
Ваша оценка?