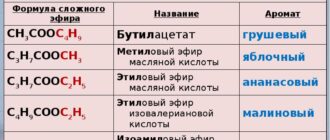
Пот. Гельмгольца: ΔZ=ΔU-TΔS.
Американский физик Гиббс предложил ввести спец. функцию, которая бы учитывала, как влияние энтрапильного так и влияние энтальпильного факторов на возможность самопроизвольного фактора того или иного процесса.
Потенциал Гиббса: ΔG=ΔH-TΔS.
Если ΔG>0 – процесс не возможен, если ΔG<0 – возможен, если ΔG=0 – система находится в равновесии.
Потенциал Гиббса позволяет объяснить, почему многие процессы, которые при стандартных условиях не протекают, становятся возможными при возрастании температуры системы. В этом случае при низких температурах основную роль в определении возможности протекания процесса играет энтальпильный фактор.
А при высоких темп. – основной вклад вносит энтрапильный фактор.
Таким образом, используя расчеты с применением термодинамической функции можно прогнозировать самопроизвольность протекания того или иного процесса.
Ваша оценка?