- Аммиак — что это такое за соединение
- История получения
- Строение молекулы
- Об основных свойствах аммиака
- Химические свойства
- Физическое воздействие
- Применение и использование
- Промышленное применение аммиака
- Применение аммиака в медицине
- Способы получения аммиака
- Влияние на человека
- Первая помощь при отравлении
- Чем отличается аммиак от нашатырного спирта
Аммиак — что это такое за соединение
Аммиак (нитрид водорода) — является бинарным неорганическим химическим соединением азота и водорода.
Формула аммиака в химии:
NH3
Строение молекулы:
В молекуле аммиака NH3 атом азота образует три одинарных ковалентных полярных связи с атомами водорода.
Схема образования молекулы:
Молекула аммиака с точки зрения геометрической формы представляет собой правильную треугольную пирамиду. Валентный угол H-N-H составляет 107,30.
Атом азота в аммиаке на внешнем энергетическом уровне содержит одну неподеленную электронную пару. Данная электронная пара существенно влияет на свойства соединения и определяет его структуру. Электронная структурная схема аммиака представляет собой тетраэдр, содержащий атом азота в центре, а в одной из вершин располагается неподеленная электронная пара:
В обычном состоянии аммиак является газом без цвета и с резким специфическим запахом. Молярная масса вещества составляет 17,0306 г/моль. Аммиак меньше по весу, чем воздух. Связь N-H является сильно полярной, что объясняет возникновение водородных связей между молекулами аммиака в жидкой фазе. При этом вещество характеризуется высокой степенью растворимости в воде. Данный факт объясняется образованием водородных связей между молекулами аммиака и молекулами воды.
История получения
Аммиак известен с давних времен. По сведениям ученых, свое название он получил в честь бога Амона, которого почитали в Древнем Египте. Образовывался газ в результате разложения мочевины в жарком климате. Резкий запах соединения египтяне связывали с культом божества.

В чистой форме аммиак H2+N2=NH3+Q получил известный ученый Джозеф Луи Пристли. В своей лаборатории он нагревал хлорид аммония с гашеной известью. Такая схема до сих пор используется, если нужно получить на выходе небольшое количество газа. Полученный аммиак Пристли собирал надо ртутью. Раствор в водной основе имеет признаки щелочи.
В 1784 году французский химик Бертолле разложил аммиак на элементный состав. Спустя 3 года было утверждено официальное название «нашатырь». Оно сохраняется до сих пор в ряде западноевропейских языков.
Строение молекулы
Электронная формула аммиака выглядит следующим образом:

Рис. 1. Электронная формула аммиака.
Из четырех электронных пар при атоме азота – три общие и одна неподеленная. В образовании молекулы NH3 участвуют три неспаренных p-электрона атома азота, электронные орбитали которых взаимно перпендикулярны, и 1s-электроны трех атомов водорода. Молекула имеет форму правильной пирамиды: в углах треугольника находятся атомы водорода, а в вершине пирамиды – атом азота. Угол между связями H-N-H равен 107,78 градусов.
Об основных свойствах аммиака
Разнообразие сфер применения аммиака обусловлено его физическими и химическими свойствами. Аммиак (химическая формула NH3) —бесцветный газ с резким неприятным запахом. При длительном действии на организм человека аммиак вызывает поражение разных органов.
Аммиак вступает в химические реакции с другими элементами и соединениями с образованием новых веществ. Например, в результате реакции безводного аммиака с азотной кислотой получают аммиачную селитру, применяемую в производстве взрывчатых веществ и азотных удобрений.
Аммиак способен восстанавливать различные металлы из их оксидов.
Химические свойства
По свойствам аммиак замечательный растворитель для разнообразных органических и неорганических составов. В твёрдом состоянии представляет собой кристаллы, не имеющие цвета. Может взаимодействовать с кислородом, хлоридом, серной кислотой, а также реагировать на водные и соляные растворы.
Аммиак обладает следующими химическими свойствами:
- Играет роль нуклеофила или комплексообразователя в химических реакциях. При присоединении протона образовывает аммоний: NH3 + H+ → NH4+.
- В жидком растворе происходит слабая щелочная реакция из-за протекающего процесса: NH 3 + H2О → NH4+ +ОН-.
- При воздействии кислот получается соль аммония, что демонстрирует уравнение: NH3 + HNO3 → NH4NO3.
- В соединении с металлами за счет кислотных свойств образует амиды: 2NH3 +2К →2КNH2 +Н2.
Состав амида, имида и нитрида металла образуют за счет реакции с аммиаком в жидком состоянии. Нитрид получают посредством прогревания металла в азотной атмосфере.
Амиды имеют идентичные свойства гидроксидам (за счет неэлектронных ионов ОН, NH2 и молекулы воды). Основание амида сильнее гидроксида, поэтому он подвержен гидролизу, который необратим.
Растворы амидов на основе аммиака проводят ток и подвержены диссоциации: MNH2 → M+ + NH2.
Фенолфталеин в составе раствора приобретает красный оттенок, но после добавления кислот наступает процесс нейтрализации.
Аммиаку в жидком состоянии свойственны ионизирующие функции растворителя, который способен растворить щелочные металлы и щелочноземельные. При этом он приобретает синий цвет. Концентрированный раствор отличается блеском металла. Во время испарения металлы из щелочи получают в целом виде, а щёлочноземельные образуют с аммиаком комплексы со свойствами проводимости металлов.
В результате происходит распадение металлических атомов на ионы, которые положительно заряжены и электроны, сульфатированные в окружении молекул NH 3. Растворы с наличием свободных электронов имеют свойства сильнейших восстановителей.
За счет электронодонорного свойства частицы аммиака могут присутствовать в комплексных соединениях в виде лигандов. Для образования аминокомплексов вводят избыточное количество аммиака в солевой раствор металла.
Химическая реакция вызывает изменение цвета реагентов. Прочными связями комплекса обладают соединения с наличием хрома и кобальта, степень окисления которого +3.
Физическое воздействие
По физическим свойствам аммиак относится к веществам, обладающим удушающими характеристиками и действием на нервную систему. При попадании в область дыхательных путей способен токсинами поразить легкие и вызвать отек с поражением разных систем живого организма. По виду действия может быть местного применения и резорбтивного.
Аммиачные пары раздражает слизистую оболочку глаза и кожные покровы. Процесс протекает с сильным неприятным запахом. Вследствие воздействия пара происходит обильное выделение слез и боли в области лица. В результате появляется ожог роговицы глаза. Зрение человека ухудшается или происходит полная его потеря. Следом наступает приступ кашля, изменение цвета кожного покрова с сильным раздражением.
Во время попадания раствора на кожу происходит жжение пораженной поверхности и образование пузырей и изъязвлений. По своим свойствам в сжатом состояние во время процесса испарения поглощает тепло. Попадая на кожу, химический элемент способен вызвать отморожение разной степени. Наличие запаха ощущается при концентрации 37 миллиграмм на метр кубический.
Норма концентрации аммиака на рабочем месте не должна превышать 20 миллиграмм на метр кубический. Работать при более тяжелых условиях без средств индивидуальной защиты запрещено.
Раздражение глаз проявляется при 490 миллиграммах концентрации в воздухе, а зева — 280. Токсичное отравление и лёгочный отек происходит при концентрации состава в 1,5 грамма на метр кубический (если находиться в области облака испарений в течение двух часов).
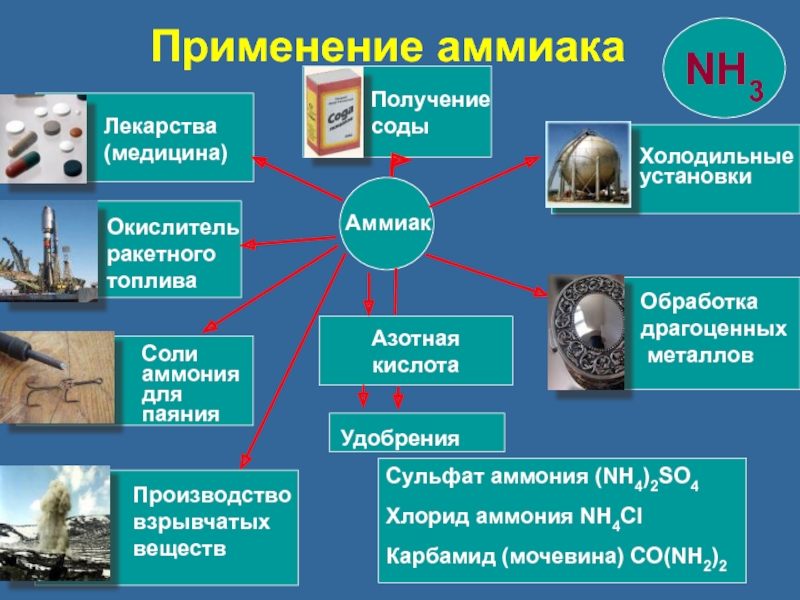
Применение и использование
Аммиак входит в большое количество веществ в промышленности. Объемы изготовления этого химического элемента достигают 150 миллионов тонн. Чаще всего производят:
- азотные удобрения (аммоний и мочевина);
- вещества на взрывчатой основе;
- азотные кислоты.
Возможно применение аммиака в роли растворителя. В холодильной промышленности встречается в виде холодильного агента (R 717).
В области медицины аммиак или нашатырный спирт (более привычное название — нашатырь) выводит человека из состояния обморока, стимулирует рвотный рефлекс. Для наружного применения используют в качестве обеззараживания укусов насекомых и при обрабатывании рук врачей. При неосторожном использовании возможно получить ожог органов пищеварения, остановку работы легких.
Применение при дерматите, кожных заболеваниях, а также повреждениях кожи в результате травмы категорически запрещено. Местное использование разрешено на здоровой области кожи. При неаккуратном применении и попадании раствора на слизистую часть глазного яблока следует обработать пострадавшую область водой или борной кислотой. Обработку необходимо повторять каждые 10 минут.
Применять вещества на масляной основе и различные мази нельзя. При попадании на область носа следует промыть ее лимонной кислотой или соком из натуральных фруктов. При попадании в область рта рекомендуется обильное употребление воды, фруктового сока.
Промышленное применение аммиака
Основная доля производимого технического аммиака используется в химической промышленности:
- для получения аммиачных и аммиачно-нитратных удобрений (аммиачной и нитратной селитры, хлористого аммония, сульфата аммония и других), широко используемых в сельскохозяйственном производстве при выращивании различных культур, а также в частном садоводстве и огородничестве;
- при получении соды аммиачно-хлоридным способом аммиаком насыщают концентрированный солевой раствор, через который под давлением пропускают двуокись углерода;
- синтетический аммиак применяется при производстве азотной кислоты, методом катализа;
- для получения аммонитов — аммиачных взрывчатых веществ;
- жидкий аммиак используют в качестве растворителя разных неорганических и органических веществ;
- в холодильных установках жидкий аммиак применяют в качестве хладагента R717;
- в качестве окислителя ракетного топлива.
Применение аммиака в медицине
Аммиак широко применяется в медицине в качестве 10% -ого раствора аммиака и имеет название – нашатырный спирт. Когда человек падает в обморок, нашатырным спиртом приводят его в чувство. Также его используют как рвотное средство. Для этого его разводят и в малых количествах принимают внутрь. Особенно популярный такой метод при алкогольных отравлениях. Из нашатырного спирта делают примочки и обрабатывают укусы насекомых. Хирурги используют разведенный в воде нашатырный спирт для обработки рук.
Важно помнить, что передозировка аммиаком очень опасна. Возможны болевые ощущения в различных органах, их отеки и даже летальный исход. Этого можно избежать, если использовать данное вещество по назначению и с осторожностью!
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопытполучения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторныйспособ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Влияние на человека

При использовании аммиака и нашатырного спирта надо помнить, что это сильно ядовитые вещества и при их использовании следует строго соблюдать дозировку и придерживаться правил пользования.
При намерении использовать аммиак приобретать его надо исключительно в аптеках и внимательно знакомиться с прилагаемыми правилами пользования «Раствор аммиака. Инструкция по применению».
Превышение дозировок может вызвать отравление и серьезные проблемы со здоровьем, а также химические ожоги. Помещения, где он применяется, должны хорошо проветриваться.
Кроме ядовитости, пары аммиака взрывоопасные. Это происходит при смешении их с воздухом в определенной пропорции, поэтому при работе необходимо соблюдать особые правила техники безопасности при работе со взрывчатыми веществами.
Первыми симптомами отравления могут быть:
- появление красных пятен на лице и теле;
- кашель, слезотечение, слюнотечение и чих;
- учащенное дыхание;
- общая возбужденность.
Дальнейшими признаками развития отравления являются:
- появление острой боли за грудиной;
- судороги;
- отек гортани;
- спазм голосовых связок;
- мышечная слабость;
- нарушение кровообращения;
- полуобморочное состояние, вплоть до потери сознания.
При приеме внутрь аммиачной воды в превышающих дозах может возникнуть:
- понос с ложными болезненными позывами;ожог пищевода, желудка и начальных отделов кишечника;
- кашель, слезотечение, слюнотечение и чих;
- остановка дыхания рефлекторного характера;
- рвота с запахом аммиака;
- прием аммиачного спирта в количестве от 10 до 15 гр. грозит летальным исходом.
Если у человека имеется индивидуальная непереносимость к запаху аммиака, то даже незначительное его попадание через дыхательные пути или вовнутрь может сразу привести к самым неблагоприятным последствиям.
Если у человека на теле имеется нарушение кожных покровов в виде мокнущих язв, экзем или дерматитов, то применение примочек может привести к еще более обширной аллергической реакции и ожогам кожных покровов.
Первая помощь при отравлении
В случаях возникновения первых признаков отравления этими веществами необходимо срочно начать оказывать пострадавшему первую помощь.
К первой помощи можно отнести следующие меры:
- вывести (в случае обморока — вынести) на свежий воздух;
- промыть водой горло и нос и напоить водой с добавлением лимонной кислоты;
- пораженные открытые участки тела обильно промыть проточной водой и накрыть повязкой для недопущения попадания на ранки инфекций;
- при попадании в пищеварительный тракт аммиака или его спирта высокой концентрации надо сделать промывание желудка, после чего напоить яичными белками, растительным маслом и молоком, после чего очистить кишечник;
- при попадании в глаза брызг аммиака их срочно надо промыть проточной водой, а кожу вокруг глаз смазать растительным маслом, при необходимости накрыть глаза повязкой.
В случае более тяжелых форм отравления необходимо срочно вызывать скорую помощь.
Аммиачный спирт обязателен в наборах медикаментов для первой помощи в аптечках и в нужный момент должен быть под рукой.
Сколько может стоить в аптеках? Ответ — совсем недорого. Приобретайте, пользуйтесь, но будьте предельно осторожны.
Чем отличается аммиак от нашатырного спирта
Основным отличием NH4OH от нитрида водорода является их агрегатное первоначальное состояние. Аммиак – бесцветный газ, который сжижается при -33 градусах Цельсия. Нашатырный спирт – это жидкость, которую часто называют раствором аммиака. Различием веществ является и область их применения. Аммиак – основной продукт, используемый в химической промышленности. Этот газ часто берут:
- при производстве спирта;
- как хладагент для поддержания работы промышленных, бытовых систем;
- для производства удобрений, полимеров, азотной кислоты, соды;
- при строительстве;
- для изготовления взрывчатых веществ.
Моногидрат аммиака имеет более узкое использование, преимущественно как медицинский антисептик. Кроме того, раствор часто применяют домохозяйки для выведения пятен с одежды, для очищения золота и серебра, как подкорму для садовых и комнатных растений. Основным сходством этих средств считается то, что они способны неприятно пахнуть из-за большого содержания аммиачных солей.
- https://wika.tutoronline.ru/himiya/class/11/himicheskie-i-fizicheskie-svojstva-ammiaka
- https://na5.club/himiya/sposoby-polucheniya-ammiaka-v-promyshlennosti-i-laboratorii.html
- https://obrazovaka.ru/himiya/ammiak-formula-plotnost.html
- https://Kriogen.ru/stati/primenenie-ammiaka/
- https://nauka.club/khimiya/ammiak.html
- https://naruservice.com/articles/sfera-primeneniya-ammiaka
- https://chemege.ru/ammiak/
- https://uborka.co/zapah/ammiak-nashatyir
- https://sovets.net/12810-nashatyrnyj-spirt.html
Ваша оценка?