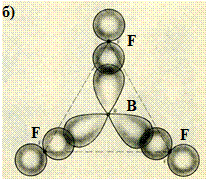
Для атомов всех элементов второго периода, имеющих сумму связей и НЭП равную четырем, возможно образование состояний близких к гибридизованному атому углерода.На рис. 26 и 27 приведены схемы образования σ-связей в молекулах хлорида бериллия, фторида бора, воды, аммиака. В молекуле BeCl2 атом бериллия находится в возбуждённом состоянии и приобретает конфигурацию [He]2s12p1. Две ковалентные связи одинаковы и образованы sp-гибридными орбиталями. Молекула имеет линейное строение (рис. 26-а). Атом бора в молекуле BF3 имеет конфигурацию [He]2s12p2, атомные орбитали вступают в sp2-гибридизацию и образуют три σ-связи. Углы между связями равны 120°, молекула плоская треугольная (рис. 26-б).
 | |||
 | |||
|
Атом кислорода в молекуле воды и атом азота в молекуле аммиака находятся в sp3-гибридном состоянии (рис. 27).
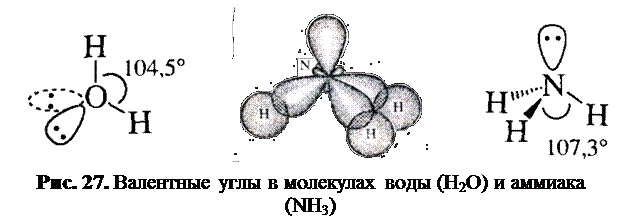 |
В 1972 г. Р. Гиллеспи, используя концепцию Полинга о гибридизации АО, сформулировал теорию отталкивания валентных электронных пар, которая устанавливает зависимость между геометрией молекулы и отталкиванием связывающих и несвязывающих электронных пар. Согласно этой теории, молекула стремится принять форму, в которой отталкивание электронных пар связей и НЭП является минимальным. Поскольку НЭП более диффузны (занимают больший объём), чем электронные пары связей, то сила их отталкивания уменьшается в направлении:неподелённые электронные пары > электронные пары связей.В соответствии с этим считается, что углы между связями Н—N—Н в молекуле аммиака (107,3º) и Н—О—Н в молекуле воды (104,5º) несколько меньше, чем нормальный тетраэдрический угол. В катионе аммония, где нет НЭП, валентный угол близок к нормальному (109,5º).
|
В молекулах органических соединений валентные состояния гетероатомов зависят от гибридизации орбиталей атомов углерода, с которыми они связаны. Если атомы азота, кислорода или галогенов образуют связь с тетраэдрическим атомом углерода, то они тоже принимают sp3-cостояние: Если гетероатомы образуют связь с sp2-гибридизованным атомом углерода, они принимают аналогичное состояние:
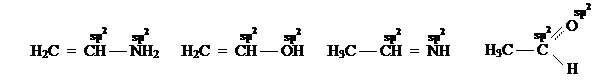 |
Гетероатомы, расположенные между sp2- и sp3-гибридизованными атомами углерода, выбирают sp2-состояние как более выгодное в данном случае в энергетическом отношении:
 |
Ваша оценка?