Заполнение электронами атомных орбиталей (АО) подчиняется трём правилам:
1. Принцип минимальной энергии (принцип устойчивости). Орбитали заполняются, начиная с имеющих самую низкую энергию, в порядке её повышения. Такое состояние называется основным. В этом случае энергия атома является минимальной, а устойчивость — максимальной.
Как выяснилось, в повышении энергии АО имеется закономерность, которая определяется с помощью правила Клечковского: ниже по энергии находится та орбиталь, для которой сумма значений главного и орбитального квантовых чисел (n+l) минимальна. Например, орбиталь 4s, для которой n+l = 4+0 = 4, заполняется раньше, чем 3d, где сумма n+l = 3+2 = 5. При равенстве сумм ниже по энергии находится орбиталь с меньшим значением главного кантового числа. Так, орбиталь 3d имеет более низкую энергию, чем 4р.
Обычный порядок заполнения атомных орбиталей имеет следующий вид:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f =5d < 6p < 7s < 5f=6d …
2. Принцип Паули. Согласно этому принципу (запрету), в атоме не может быть двух электронов с одинаковыми наборами значений квантовых чисел n, l, ml, ms. На любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют антипараллельные спины.
3. Правило Хунда (Гунда). В каждом квантовом слое одноимённые орбитали (орбитали одного подуровня) вначале заполняются однократно электронами с параллельными спинами, с тем, чтобы суммарный спин атома был максимальным; лишь после этого начинается спаривание электронов.
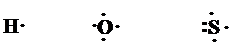 Эти три правила характеризуют электронную конфигурацию атомов различных элементов в основном состоянии. Электроны внешнего энергетического уровня иногда называют валентными электронами. Г.Н.Льюис предложил изображать валентные электроны с помощью точек, которые ставятся рядом с химическим знаком элемента:
Эти три правила характеризуют электронную конфигурацию атомов различных элементов в основном состоянии. Электроны внешнего энергетического уровня иногда называют валентными электронами. Г.Н.Льюис предложил изображать валентные электроны с помощью точек, которые ставятся рядом с химическим знаком элемента:
Такие обозначения получили название символов Льюиса.
Любая атомная орбиталь, в том числе и валентная, может иметь только три состояния:
— орбиталь не занята электронами — свободная или вакантная орбиталь;
— орбиталь занята одним электроном (неспаренный электрон), спин не компенсирован;
— орбиталь занята парой электронов с компенсированными спинами (неподелённой электронной парой).
Приведённые выше изображения атомных орбиталей (рис. 1-5) и соответствующие им наборы квантовых чисел справедливы, независимо от того, имеется ли на них неспаренный электрон, неподелённая электронная пара или не содержится ни одного электрона.
Если атом в пределах одного квантового слоя имеет неподелённую электронную пару и свободную орбиталь, он может переходить в возбуждённое состояние, переводя один электрон на следующий подуровень с изменением спина. У химического знака атома в возбуждённом состоянии ставится звёздочка (*), например, С*.
Очень важными характеристиками атома являются его магнитные свойства, в частности — диамагнетизм и парамагнетизм. Парамагнитными называются частицы, имеющие неспаренные электроны (некомпенсированные спины) и обладающие собственным магнитным моментом. Они взаимодействуют с внешним магнитным полем (втягиваются в него). Диамагнитные частицы не имеют неспаренных электронов, все их спины компенсированы. У них отсутствует собственный магнитный момент, потому они не взаимодействуют с магнитным полем.
Ваша оценка?






