- Определение водорода
- Положение в периодической системе химических элементов
- Электронное строение водорода
- Водород его формула и молярная масса
- Химические свойства
- Физические свойства
- Соединения водорода
- Методы производства водорода
- Промышленный метод получения водорода .
- Лабораторный метод получения водорода.
- Вычисление водорода
- Сырье и продукты
- Технологическая схема
- Очистка сырья
- Предриформинг
- Риформинг
- Конверсия окиси углерода и охлаждение синтез-газа
- Короткоцикловая адсорбция водородсодержащего газа
- Блок утилизации тепла дымовых газов
- Способы получения
- Паровая конверсия
- Разделение метана на углерод и водород
- Электролиз воды
- Пиролиз
- Как превратить воду в водород: простейший опыт
- Применение водорода
- Распространение водорода в природе
Определение водорода
Водород — самый распространенный во Вселенной элемент. Он составляет основную часть массы Солнца и других звезд. Водород входит в состав газообразных туманностей, межзвездного газа, звезд во Вселенной, где его атомы превращаются в атомы гелия. Этот процесс происходит с выделением энергии (термоядерная реакция), что служит для многих звезд, в том числе и Солнца, основным источником энергии.

Рис.23 Полет воздушного шара, заполненного водородом. Париж, 1783 г.
Эта энергия необходима для многих природных процессов. Солнечная энергия согревает Землю, приводит в движение воздушные массы атмосферы и воду рек, морей и океанов, обеспечивает процесс фотосинтеза у зеленых растений, наконец, является основным условием для существования жизни.
Водород широко распространен на Земле в виде свободной воды, кристаллизационной воды минералов, метана и углеводородов нефти, различных гидроксидов, растительной и животной биомассы, органического вещества почвы.
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии:
+1H 1s1 1s ![]()
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Водород его формула и молярная масса
Как простое вещество водород состоит из двух атомов 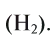
. Его относительная молекулярная масса равна ~ 2 г/моль, он является самым легким и хорошо проводящим теплоту газом. При обычных условиях он встречается в атмосфере в небольших количествах. Водород обладает способностью растворяться в металлах. Как самый легкий газ, он обладает самой большой скоростью диффузии. Его молекулы по сравнению с молекулами других газов быстро распределяются в среде соответствующего вещества, легко проходят через различные препятствия. При высоком давлении и температуре эта его способность значительно возрастает.
Физические свойства. Водород — это газ без цвета, вкуса и запаха, плохо растворяется в воде (в 1 л при нормальных условиях растворяется 21,5 мл), хорошо растворяется в некоторых металлах (никель, палладий, платина). Это самый легкий газ — в 14,5 раз легче воздуха. Температура кипения -252,6°С; при -259, ГС образуются прозрачные кристаллы.
Химические свойства
При обычной температуре активность молекулярного водорода небольшая, но атомарный водород очень активен.
Водород образует летучие соединения почти со всеми неметаллами. В зависимости от активности неметалла реакция протекает быстро или медленно.
1. Со фтором он взаимодействует уже при комнатной температуре:
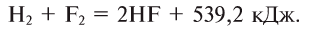
2. С хлором вступает в реакцию на свету, а при нагревании взрывается (в темноте и без нагревания соединяется медленно):

3. При обычных условиях с кислородом не взаимодействует. Смесь водорода и кислорода в объемном соотношении 2:1 называется «гремучим газом», который при внешнем воздействии взрывается. Водород горит в кислороде:
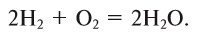
При этой реакции температура может достичь 3000°С.
Со многими неметаллами водород вступает в реакцию при высоких температуре и давлении, в присутствии катализаторов (например, с серой и азотом).
1. При высоких температурах водород восстанавливает (вытесняет) металлы из их оксидов:
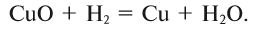
2. Щелочные и щелочноземельные металлы образуют с водородом при высоких температурах солеподобные соединения — гидриды:
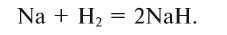
Атомарный водород при комнатной температуре вступает в реакцию с серой, мышьяком, фосфором, кислородом, восстанавливает металлы из оксидов.
Физические свойства
Водород– легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др. вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Методы производства водорода
- паровая конверсия метана и природного газа;
- газификация угля;
- электролиз воды;
- пиролиз;
- частичное окисление;
- биотехнологии.
Промышленный метод получения водорода .
1. Электролиз водных растворов солей (поваренная соль NaCl).
2. Пропускание паров поды над раскаленным коксом (Т = 1000 °С):
H2O + C = H2 ↑+ CO,
Реакция обратима!
Смесь (Н2, СО и Н2О) называется водяным газом.
А на 2-ой стадии водяной газ пропускают над оксидом железа (III) при температуре около 450°С:
СО + Н2О = СО2 + Н2↑,
Часто эту реакцию называют реакцией сдвига.
3. Получение из природного газа. Основа – конверсия метана (основной компонент природного газа, СН4) с водяным паром. В итоге получается обратимая смесь, которая называется синтез-газом. Условия протекания процесса: никелевый катализатор и 1000°С:
СН4 + Н2О = СО2 + 3Н2↑,
Эту реакцию часто используют для получения водорода для реакции Габера (синтез аммиака).
4. Крекинг нефтяных продуктов.
Лабораторный метод получения водорода.
1. Под воздействием разбавленных кислот на металлы, которые стоят в ряду напряжения левее водорода.
Zn + HCl = ZnCl2 + H2↑,
2. Электролиз растворов кислот, щелочей на катоде выделяется водород.
3. Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
4. Гидролиз гидридов:
NaH + H2O = NaOH + H2↑,
5. Реакция кальция с водой:
Ca + 2H2O = Ca(ОН)2 + H2↑.
Вычисление водорода
В химических реакциях наряду с жидкими и твердыми веществами участвуют и газы. Осуществление расчетов с газообразными веществами происходит обычно в единицах объема 
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул. Например, в 22,4 л любого газообразного вещества при 0°С и 101,325 кПа содержится 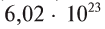
молекул.
Плотность газа р — это отношение молярной массы газа (М) к его молярному объему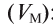
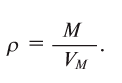
Относительная плотность газов рассчитывается как отношение их молекулярных масс по уравнению:
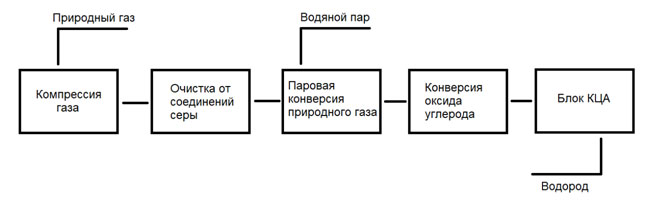
Сырье и продукты
На российских НПЗ наиболее распространенным методом получения водорода является паровая конверсия углеводородов (СУГ, нафты, природного газа).
Продуктами являются чистый водород с концентрацией >99% об., а также отдувочный газ, который чаще всего используется в качестве топлива для печей.
Технологическая схема
В состав установки производства водорода входят следующие блоки и узлы:
- блок подготовки и очистки сырья;
- блок предриформинга;
- блок парового риформинга;
- блок конверсии и охлаждения конвертированного газа;
- блок очистки водородсодержащего газа по технологии КЦА;
- блок утилизации тепла продуктовых потоков и дымовых газов.
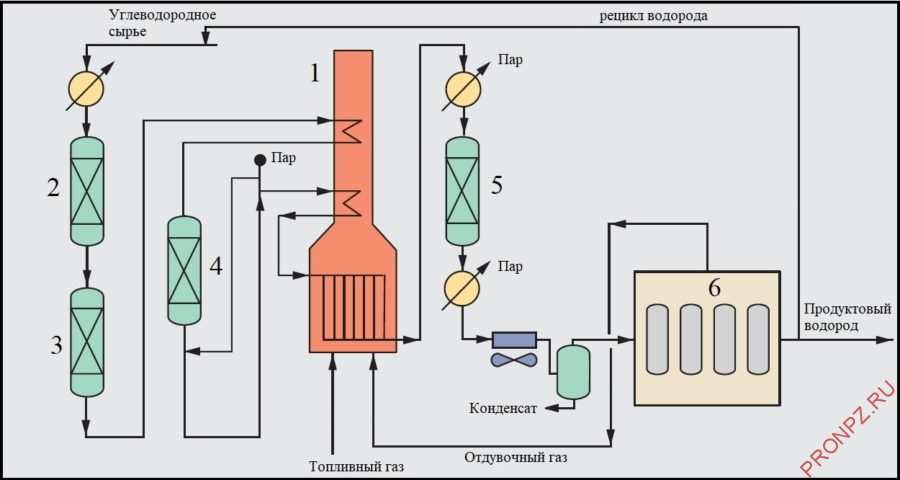
Принципиальная схема установки производства водорода методом паровой конверсии 1 – печь риформинга; 2 – реактор гидрообессеривания; 3 – адсорберы; 4 – реактор предриформинга; 5 – реактор конверсии СО; 6 – блок короткоцикловой адсорбции (КЦА)
Очистка сырья
Природный газ поступает в подогреватель, нагревается до температуры 40 °С. Для гидрирования сернистых соединений, содержащихся в сырье, до сероводорода, требуется небольшое количество водорода.
С этой целью часть водорода, полученного на установке, подается в качестве рециркуляционного водорода в поток сырья. Смесь сырья и рециркулирующего водорода, последовательно поступая в теплообменники, нагревается до температуры 380 °С, необходимой для предварительной очистки сырья.
Кстати, прочтите эту статью тоже: Установка гидрокрекинга
Подогретая газосырьевая смесь поступает в реактор гидрообессеривания, где происходит гидрирование соединений серы до H2S. Газосырьевая смесь из реактора последовательно проходит через адсорберы, где происходит улавливание хлоридов (НСl) и сернистых соединений (H2S). В каждом из этих реакторов имеется три слоя катализатора:
- модифицированный оксид алюминия для удаления НСl,
- оксид цинка,
- слой специального катализатора для эффективного и глубокого удаления H2S.
Предриформинг
Очищенная газосырьевая смесь смешивается с перегретым паром высокого давления. Соотношение расходов регулируется с поддержанием заданного мольного соотношения водяного пара и углерода. Величина значения этого соотношения зависит от типа сырья, подаваемого на установку.
Далее парогазовая смесь нагревается до температуры реакции 475 °С – 500 °С, в змеевике подогрева сырья предриформинга, расположенном в конвекционной секции печи парового риформинга и направляется в реактор предриформинга.
Предриформинг служит для превращения тяжелых углеводородов, содержащихся в сырье, в метан, а также для частичного проведения реакций риформинга, при этом эффективность процесса повышается.
В зависимости от типа перерабатываемого сырья, может наблюдаться увеличение или снижение общей температуры по реактору. Так при переработке бензинов увеличивается общая температура по реактору, за счет преобладания протекания реакций с экзотермическим эффектом, а при переработке природного газа температура по реактору падает, за счет протекания реакций с эндотермическим эффектом.
Риформинг
Парогазовая смесь нагревается до температуры 650 °С в змеевике подогрева сырья риформинга, расположенном в конвекционной секции печи парового риформинга, и затем поступает в коллектор, расположенный в радиантной секции печи парового риформинга.
В радиантной секции печи парового риформинга смесь сырья и пара поступает в катализаторные трубы, находящиеся в радиантной секции печи парового риформинга Н-1, проходит сверху вниз катализаторные трубы. В результате реакции, протекающей на катализаторе, загруженном в катализаторные трубы, получается равновесная смесь, состоящая из Н2, СО, СO2, СН4 и Н2O.
Для предотвращения образования кокса и отложения его на катализаторе технологический пар подается в избытке, превышая стехиометрическое количество, требуемого на реакцию.
Полученный конвертированный газ (парогазопродуктовая смесь) выходит из печи парового риформинга при температуре 888 °С и далее направляется в теплообменник. В теплообменнике происходит охлаждение питательной воды до температуры 320-343 °С, регенерированное тепло используется для генерирования насыщенного пара высокого давления.
Общий тепловой эффект реакций парового риформинга является в сильной степени эндотермическим, поэтому для достижения требуемой степени конверсии необходим подвод тепла.
Конверсия окиси углерода и охлаждение синтез-газа
Водородсодержащий газ после парового риформинга и охлаждения поступает в реактор высокотемпературной конверсии, где избыточный пар превращает большую часть СО в С02 и Н2 при прохождении через слой катализатора.
Синтез-газ, подвергнутый конверсии, охлаждается, отдавая тепло потокам системы выработки водяного пара. Далее частично охлажденный синтез-газ поступает в воздушный, а затем на доохлаждение в водяной холодильник, где охлаждается до температуры 35 °С и поступает в сепаратор для разделения смеси на неочищенный водород и технологический конденсат.
Технологический конденсат смешивается с химочищенной водой, поступающей из сетей завода и направляется в деаэратор, а неочищенный водород подается в блок короткоцикловой адсорбции.
Короткоцикловая адсорбция водородсодержащего газа
Поток неочищенного водородсодержащего газа поступает в блок короткоцикловой адсорбции (КЦА), где происходит удаление примесей в процессе циклической адсорбции. Для выполнения заданной степени концентрирования водорода и удаления примесей в процессе используются многочисленные адсорбционные слои. Принятая схема блока позволяет извлечь водород с концентрацией 99,5 % (об.) из конвертированного газа, а сбросной газ направляется в качестве топлива в реакторную печь.

Блок короткоцикловой адсорбции (КЦА)
В блоке КЦА происходит очистка конвертированного водородсодержащего газа от примесей метана, окислов углерода путем адсорбции загрязнений на адсорбенте при высоком давлении и десорбции при низком давлении.
Блок утилизации тепла дымовых газов
В блоке утилизации тепла дымовых газов и продуктовых потоков производится водяной пар высокого давления за счет охлаждения дымовых газов и продуктовых потоков. Одновременно с этим предусмотрено использование тепла дымовых газов для нагрева питательной воды, перегрева производимого водяного пара и подогрева воздуха, подаваемого к горелкам печи.
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Паровая конверсия
Более 50% всего водорода получается путём паровой конверсии воды и метана. При этом три основных составляющих (природный газ, водяной пар и оксиген) смешиваются в определённых пропорциях.
Таким образом, часть природного газа сгорает вместе с кислородом, тем самым поддерживая необходимую температуру для продолжения химической реакции. Метан, не выгоревший во время реакции конверсии, реагирует с водяным паром, образуя оксид углерода (то есть сажу) и непосредственно гидроген.
Простота и относительная лёгкость делает производство водорода путём паровой конверсии наиболее дешёвым из всех доступных.
Разделение метана на углерод и водород
Второй метод получения гидрогена – крекинг метана, простейшего по составу углеводорода. Благодаря специальному процессу сжиженный метан нагревается до температур свыше 1000-1400 °С, после чего газ начинает разлагаться на гидроген и карбон.
Благодаря дешевизне метана, а также простому способу его получения, такой тип добычи водорода проще всего. Однако высокие температуры и потенциальная пожароопасность требуют дополнительных мер безопасности. К тому же, оборудование для полного процесса крекинга не из дешёвых.
Электролиз воды
Ещё один вид добычи гидрогена – электролиз воды. Это второй по распространённости метод добычи водорода, обеспечивающий достаточно высокую чистоту конечного продукта. Сопутствующим «бонусом» в этом технологическом процессе становится кислород, не менее важный элемент.
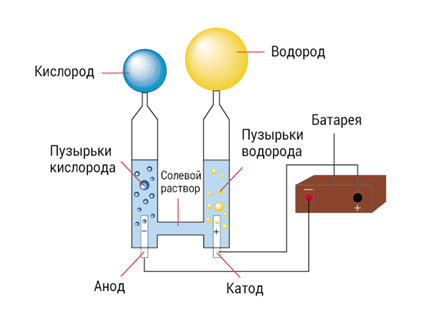
Для такого способа производства требуются значительные запасы воды. Тем не менее он совсем не требователен к её качеству – для электролиза можно использовать промышленную, дождевую или даже сточную воду.
Пиролиз
Последняя из наиболее распространённых методик – пиролиз. Иными словами – разложение органики при помощи термической обработки.
«Топливом» для этого могут служить отходы сельского хозяйства и пищевых производств:
- Птичий помёт и другие побочные продукты животноводства.
- Отходы рыбных, соко- и мясокомбинатов.
- Некоторые виды технических культур, специально выращенных для получения биомассы.
При переработке всех этих биоотходов при помощи специальных бактерий образуется синтез-газ, в основном состоящий из двуокиси карбона и метана. Продуктом их переработки и становится гидроген.
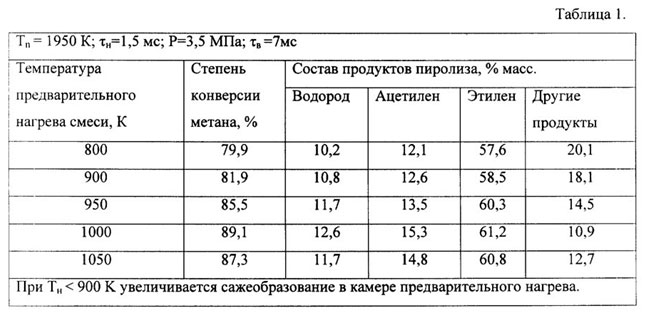
Такой способ производства набирает всё большую популярность ввиду того, что, помимо гидрогена, из биомассы добываются этилен и ацетилен. Также ценным сырьём являются и сами биоотходы, которые широко используются в сельском хозяйстве для производства удобрений.
Как превратить воду в водород: простейший опыт
Солнечный генератор водорода / кислорода DIY — простой «электролиз» с использованием солнечного света! (превращает воду в топливо).
Соблюдайте безопасность в опытах с воспламеняющимися веществами!


Я покажу вам, как сделать простое устройство, которое превращает / расщепляет воду на водород и кислород. Это удивительно просто и прекрасно работает. (не забудьте посмотреть видео, так как оно показывает много дополнительных деталей — в том числе пузырьки, просто вылетающие из карандашей). Видео показывает, что генератор водорода питается от солнечной батареи, батареи 9 В и трансформатора переменного / постоянного тока.
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Распространение водорода в природе
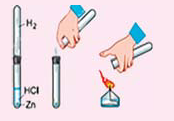
Влейте в пробирку немного разбавленной серной или соляной кислоты и опустите туда 2-3 кусочка цинка или алюминия. Подождите, когда из пробирки выйдет весь воздух, и потом подожгите полученный водород. Что вы наблюдаете? Запишите уравнение реакции.
Общая характеристика:
- Химической знак: Н
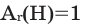
- Химическая формула простого вещества:
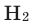
- Относительная молекулярная масса простого вещества:
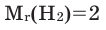
- Валентность: I
- Относительная атомная масса:
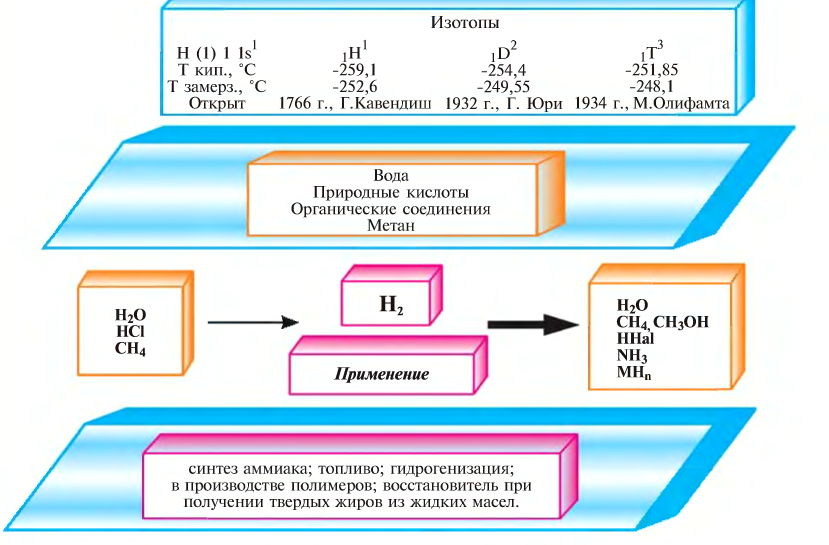
На земном шаре водород по массе составляет 1%. Элемент водорода содержится в составе большинства органических соединений. Водород считается самым распространённым химическим элементом во вселенной (в космосе). Примерно 50% Солнца и все звёзды состоят в основном из водорода. Как вы знаете, в природе существует три изотопа водорода — Протий: 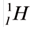 Дейтерий:
Дейтерий: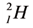 Тритий:
Тритий: 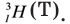
Наиболее широко распространённым в природе является Протий, наименее встречаемым — Дейтерий и в минимальном количестве, редко встречаемым — Тритий.
Впервые водород в чистом виде был получен английским учёным Г. Кавендишем в 1766 году.

Английский ученый. В 1766 году им был получен водород в чистом виде. Ученый вначале принял водород вследствие его легкости за флогистон.
- https://www.evkova.org/vodorod-kak-himicheskij-element-v-himii
- https://chemege.ru/hydrogen/
- https://pronpz.ru/ustanovki/steam-reformer-unit.html
- https://www.calc.ru/Vodorod-Polucheniye-Vodoroda.html
- https://biznesprost.com/otkryt-biznes/proizvodstvo-vodoroda.html
- https://izobreteniya.net/kak-iz-vodyi-izvlech-vodorod/
Ваша оценка?