Атомный радиус. За радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус. При изучении строения молекул и кристаллов атомы и ионы можно рассматривать как имеющие некий эффективный радиус, зависящий от типа химической связи. Если рассматривать только относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента.
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром.
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек.
У s- и p-элементов изменение радиусов как в периодах, так и в подгруппах более ярко, чем у d- и f-элементов, поскольку d- и f-электроны внутренние. Уменьшение радиусов у d- и f-элементов в периодах называется d— и f-сжатием. Следствием f-сжатия является то, что атомные радиусы электронных аналогов d-элементов пятого и шестого периодов практически одинаковы:
|
| Zn – Hf | Nb – Ta |
| rатома, нм | 0,160 – 0,159 | 0,145 – 0,146 |
Таблица 2.3.
Эти элементы из-за близости их свойств называются элементами-близнецами.
Образование ионов приводит к изменению ионных радиусов по сравнению с атомными. При этом радиусы катионов всегда меньше, а радиусы анионов всегда больше соответствующих атомных радиусов. Ковалентный радиус равняется половине межатомного расстояния в молекулах или кристаллах простых веществ. Ионные радиусы элементов представлены в табл. 2.4.
Энергией ионизации атома I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома или иона.
Энергия ионизации I выражается в кДж∙моль–1 или эВ∙атом–1. Значение I в электронвольтах численно равно потенциалу ионизации, выраженному в вольтах, поскольку E = e–·I.
Э+ – e– = Э+, ΔH = I1 – первый потенциал ионизации; Э – e– = Э2+, ΔH = I2 – второй потенциал ионизации и т.д. I1 < I2 < I3 < I4…
Энергия ионизации определяет характер и прочность химической связи и восстановительные свойства элементов.
|
Таблица 2.5. Потенциалы (энергии) ионизации I1.
Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов (рис. 2.4).
I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду I1 резко понижается – он минимален у щелочных металлов.
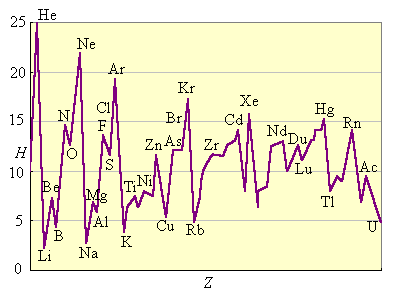
Рисунок 2.4. Потенциалы ионизации нейтральных атомов.
Энергия связи электрона с ядром пропорциональна Z и обратно пропорциональна среднему (орбитальному) радиусу оболочки. Атомные радиусы d- и f-элементов с ростом Z в периоде уменьшается незначительно по сравнению с s- и p-элементами, поэтому их потенциалы ионизации растут также незначительно.
В главных подгруппах потенциалы ионизации с ростом Z уменьшаются вследствие увеличения числа электронных подоболочек и экранирования заряда ядра электронами внутренних подоболочек.
В побочных подгруппах d-электроны экранируются не только электронами заполненных оболочек, но и внешними s-электронами. Поэтому потенциал ионизации d-элементов с ростом Z в подгруппе увеличивается, хотя и незначительно.
Чем меньше потенциал ионизации, тем легче атом отдает электрон. Поэтому восстановительная способность нейтральных атомов с ростом Z в периоде уменьшается, в главных подгруппах растет, а в побочных – падает.
Энергия сродства к электрону. Другой важной в химии характеристикой атома является энергия сродства к электрону – энергия, выделяющаяся при присоединении электрона к нейтральному атому. Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Экспериментальное определение энергии сродства к электрону E значительно сложнее, чем определение энергии ионизации. Величины E (в эВ) для некоторых атомов приведены ниже:
|
| H | He | Li | Be | B | C | N | O | F | Ne |
| E, эВ | 0,75 | –0,22 | 0,8 | –0,19 | 0,30 | 1,27 | –0,21 | 1,47 | 3,45 | –0,57 |
Таблица 2.6. Значение энергии сродства к электрону E для некоторых атомов.
Немонотонность изменения сродства к электрону в периоде также обусловлена сравнительной устойчивостью полностью и наполовину заполненных подоболочек. Самый сильный из всех элементарных окислителей – фтор (он обладает и самым малым атомным радиусом из всех элементов VII группы).
Отметим, что в отличие от ионизации присоединение двух и более электронов энергетически затруднено, и многозарядные одноатомные отрицательные ионы в свободном состоянии не существуют.
Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2 и s2p6 и переходные элементы. У остальных элементов в таблице Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
В периодах электроотрицательность растет, а в группах уменьшается с ростом Z, то есть растет от Cs к F по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сходство элементов.
| H |
| |||||||
| Li | Be |
| B | C | N | O | F | |
| Na | Mg |
| Al | Si | P | S | Cl | |
| K | Ca | Sc 1,3 | Fe 1,8 | Ga | Ge | As | Se | Br |
| Rb | Sr | Y 1,2 | Ru 2,2 | In | Sn | Sb | Te | I |
| Cs | Ba | La 1,0 | Os 2,2 | Tl | Pb | Bi | Po | At |
|
| Ce-Lu |
|
Таблица 2.7. Электроотрицательность элементов.
В главных и побочных подгруппах свойства элементов меняются немонотонно, что обусловлено так называемой вторичной периодичностью, связанной с влиянием d- и f-электронных слоев.
Из анализа периодичности геометрических и энергетических параметров атомов следует, что периодическим законом можно пользоваться для определения физико-химических констант, предсказывать изменение радиусов, энергий ионизации и сродства к электрону, и, следовательно, кислотно-основные и окислительно-восстановительные свойства их соединений.
Ваша оценка?








