процесс разрушения металла под действием коррозионной среды, в которой отсутствует жидкая вода. Например, химическая коррозия наблюдается при действии на металл сухих газов (воздуха или продуктов горения топлива и т. п.),
а также жидких неэлектролитов (нефти, бензина и т. п.).
– окисление металла в присутствии электролита, сопровождающиеся возникновением гальванической пары. Таким образом, при электрохимической коррозии
наряду с химическим процессом протекает и процесс электрохимический – движение электронов от одного участка системы к другому.
§ Анодный процесс, состоящий в переходе атомов металла
в раствор в виде гидратированных ионов, причем на металле остается эквивалентное количество электронов;
§ Катодный процесс, заключающийся в связывании этих избыточных электронов окислителем из окружающей среды.
Коррозия может происходить только при одновременном протекании анодного и катодного процессов.
ионов металла в раствор с их одновременной гидратацией: 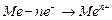 . Электроны же перемещаются на катодные участки, потенциал, которого более положителен.
. Электроны же перемещаются на катодные участки, потенциал, которого более положителен.
Ox – окислитель среды; Red – его восстановленная форма. Скорость электрохимической коррозии зависит от ряда факторов, в том числе от электродного потенциала на границе металл/электролит.
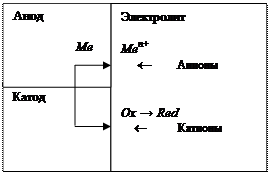 |
Рис. 5.1. Схема коррозионного процесса
При электрохимической коррозии с кислородной деполяризацией окислителем, принимающим электроны, является растворенный кислород, имеют место следующие электродные процессы:
катодный процесс: 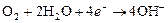 .
.
катодный процесс: 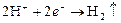 .
.
от железа к меди, а ионы водорода в растворе будут перемещаться к поверхности меди, где будут восстанавливаться этими электронами:
На поверхности железа: 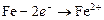 .
.
На поверхности меди: 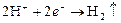 .
.
восстанавливается кислород, растворенный в электролите, т. е. имеет место процесс:
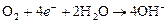 .
.
Одновременно имеет место процесс образования ионов железа (II):
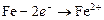 .
.
Ионы железа дают с ионами 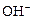 гидроксид железа (II):
гидроксид железа (II):
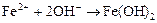
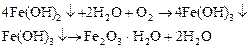
Ваша оценка?



