Большинство химических реакций является обратимыми, т.е. они протекают одновременно в двух противоположных направлениях – прямом (®) и обратном (¬), например:
N2(г) + 3Н2(г) « 2NH3(г)
Состояние системы, при котором скорости прямой и обратной реакций равны, называется химическим равновесием. В состоянии равновесия концентрации реагентов и продуктов постоянны; их называют равновесными и обозначают квадратными скобками [ ].
Для приведенной реакции условие химического равновесия запишется так:
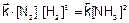
Любое химическое равновесие количественно характеризуется константой равновесия – это отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам. Для реакции в общем виде:
aA + bB « dD + fF
константа химического равновесия, выраженная через молярные концентрации веществ, запишется так:
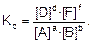 (1)
(1)
Уравнение (1) является выражением закона действия масс для обратимых реакций.
Если реакция протекает в газовой фазе, то константа равновесия рассчитывается через равновесные парциальные давления. Например, для вышеприведенной реакции синтеза аммиака:
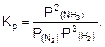 (2)
(2)
Константа равновесия зависит от природы реагирующих веществ, температуры, но не зависит от концентрации реагентов. Значение константы равновесия определяет глубину превращения исходных веществ в продукты реакции. При Кс>>1 равновесие обратимой реакции смещено в сторону прямой реакции, т.е. реакция дает большой выход продуктов. При Kc<<1 выход продуктов очень мал и равновесие смещено в сторону исходных веществ.
Каждое химическое равновесие устанавливается при определенных условиях: концентрациях, температуре, давлении для газов. Изменение одного из параметров приводит к нарушению и смещению равновесия. Направление смещения равновесия определяется правилом Ле Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие системы сместится в сторону той реакции, которая ослабляет это воздействие.
1. При уменьшении концентрации одного из веществ равновесие смещается в сторону реакции, которая образует это вещество. При увеличении концентрации вещества равновесие смещается в сторону реакции, которая расходует это вещество.
2. Повышение температуры смещает равновесие в сторону эндотермической реакции, а понижение – в сторону экзотермической реакции.
3. Изменение давления оказывает влияние на равновесие в том случае, если в реакции участвуют газообразные вещества. При повышении внешнего давления равновесие смещается в сторону той реакции, которая сопровождается уменьшением количества газообразных веществ, т.е. уменьшением объема. Наоборот, при понижении внешнего давления равновесие смещается в сторону увеличения количества газообразных веществ, т.е. увеличения объема.
Пример 1. При синтезе аммиака
N2(г) + 3Н2(г) « 2NH3(г)
Равновесие установилось при следующих концентрациях реагирующих веществ, моль/л:
[N2]=2,5; [H2]=1,8; [NH3]=3,6.
Рассчитайте константу равновесия этой реакции и начальные концентрации азота и водорода.
Решение.
1. Рассчитаем Кс:
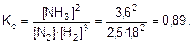
Начальные концентрации азота и водорода найдем исходя из стехиометрии реакции
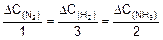
2. Найдем количество прореагировавшего азота
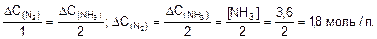
3. Найдем начальную концентрацию азота:
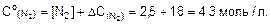
4. Найдем количество прореагировавшего водорода
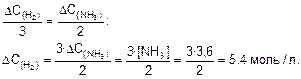
5. Найдем начальную концентрацию водорода
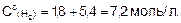
Ответ. Кс=0,89; 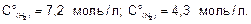
Пример 2. Объемный состав реакционной смеси в момент равновесия для реакции
2СО2(г) « 2СО(г) + О2(г)
был следующий: 88,72% СО2; 7,52% СО; 3,76% О2. Вычислите константу равновесия для этой реакции, если общее давление в системе равно 1,083×105 Па.
Решение.
1. Определим парциальное давление реагирующих веществ:
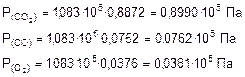
2. Рассчитаем Кр:
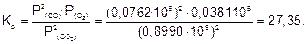
Ответ. Кр=27,35.
Пример 3. Реакция протекает по уравнению
4HCl(г) + O2(г) « 2Н2О(г) + 2Cl2(г)
В каком направлении сместится химическое равновесие, если концентрации всех реагирующих веществ увеличить в 2 раза?
Решение.
1. Скорости прямой и обратной реакций в момент равновесия были следующие:
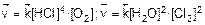
2. Найдем скорость прямой и обратной реакций после увеличения концентраций в 2 раза
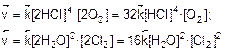
Скорость прямой реакции возросла в 32 раза, а обратной – в 16 раз. Следовательно, равновесие сместится в сторону прямой реакции.
Ответ. При увеличении концентраций всех веществ в 2 раза равновесие сместится в сторону прямой реакции.
Пример 4. Равновесие реакции
2NO(г) + О2(г) « 2NO2(г)
установилось при следующих концентрациях реагирующих веществ, моль/л: [NO]=0,5; [O2]=0,7; [NO2]=2,1. В сторону какой реакции сместится равновесие, если в системе уменьшить общее давление в 2 раза?
Решение.
1. Найдем скорости прямой и обратной реакций в момент равновесия:
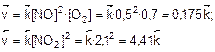
2. При уменьшении давления в 2 раза концентрации всех реагирующих веществ уменьшатся в 2 раза. Найдем скорости прямой и обратной реакций после уменьшения давления:
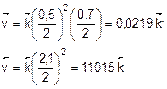
3. Найдем, как изменятся скорости прямой и обратной реакций после уменьшения давления:
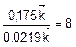 , т.е. скорость прямой реакции уменьшится в 8 раз.
, т.е. скорость прямой реакции уменьшится в 8 раз.
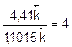 , т.е. скорость обратной реакции уменьшится в 4 раза.
, т.е. скорость обратной реакции уменьшится в 4 раза.
Ответ. Равновесие реакции сместится в сторону обратной реакции.
Пример 5. В какую сторону сместится равновесие реакции
АВ « А + В,
если повысить температуру на 30 градусов? Температурные коэффициенты прямой и обратной реакций, соответственно, равны 2 и 3.
Решение.
В соответствии с правилом Вант-Гоффа при повышении температуры на 30° скорость прямой реакции возрастет в
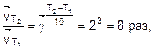
а скорость обратной реакции возрастет в
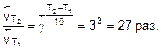
Ответ. При повышении температуры на 30° равновесие сместится в сторону обратной реакции.
Ваша оценка?







