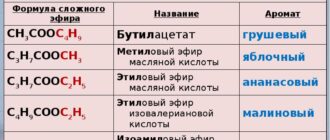
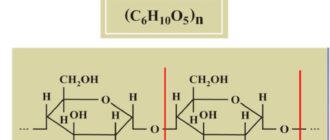
Термодинамика, как наука возникла в связи с необходимостью научного описания процессов превращения тепловой энергии в механическую работу. Это, в стою очередь, было вызвано широким внедрением в промышленность паровых двигателей. Позднее задачами термодинамики стало описание энергетических процессов, их способов трансформации энергии из одного вида в другой. Исходя из этого можно считать, что химическая термодинамика – наука об энергетических эффектах химических процессов. Базовым понятием термодинамики является понятие системы, т.е. некоторые совокупности элементов выделены из окружающей среды. Системы подразделяются на открытые (обмениваются и энергией и веществом), закрытые (только энергией) и изолированные (невозможен).
Система характеризуется некоторым набором свойств – параметры состояния. В химии часто используются P, V, T. Связь между параметрами называется уравнением состояния: PV = (m/M)*RT.
Все системы можно ох-ть с помощью внутренней энергии (U) – энергия частиц, составляющих донное тело.
Определить значение внутренней энергии очень сложно. Обычно используют изменение внутрен. э. (ΔU). Во внутреннюю энергию не входит потенциальная и кинетическая. Вн.э. зависит от начального и конченого состояния системы и на зависит от того, каким путем осуществлялось данное изменение. Называется функция состояния – зависит от начального и конечного состояния системы и не зависит от пути изменения системы.
Ваша оценка?