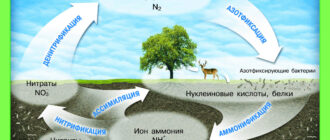
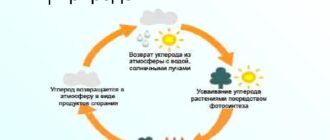
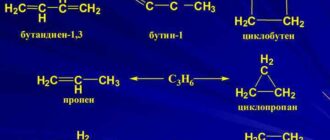
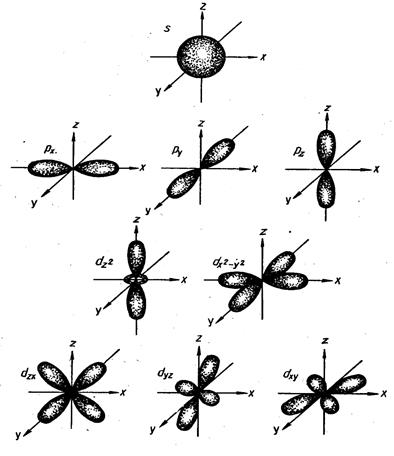
Считалось, что при повышении температуры увеличивается кол-во столкновений между частицами реагирующих веществ, что и приводит к хим. взаимодействию.
Но при обычной темп. число столкновений и так очень велико.
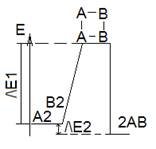 Выяснили, что существует энергетический барьер, который необходимо преодолеть для того, чтобы молекулы вещ-ва вступили в реакцию. Назыв. – энергия активации. Вычисляется по уравнению Аррениуса: lnk = a/T + b, но в настоящее время: k = Ae-ΔE/RT, ΔE – энергия активации, А – const.
Выяснили, что существует энергетический барьер, который необходимо преодолеть для того, чтобы молекулы вещ-ва вступили в реакцию. Назыв. – энергия активации. Вычисляется по уравнению Аррениуса: lnk = a/T + b, но в настоящее время: k = Ae-ΔE/RT, ΔE – энергия активации, А – const.
Для того, чтобы вещ-ва вступили в реакцию, им нужно сообщить некоторую энергию.
В результате образуется активированный комплекс, и он распадается с образованием продуктов реакции.
ΔE1 – энергия активации; ΔE2 – энергия эффекта хим. реакции (по з. Гесса).
ышении температуры увеличивается кол-во столкновений между частицами реагирующих веществ, что и приводит к
Ваша оценка?