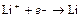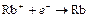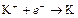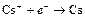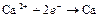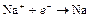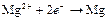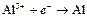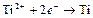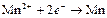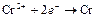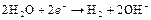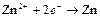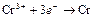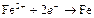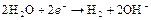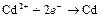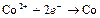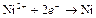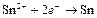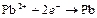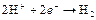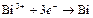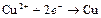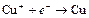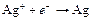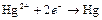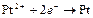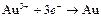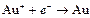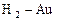к окислительно-восстановительным взаимодействиям в водных растворах при стандартных условиях. Ионы металлов являются окислителями, а металлы в виде простых веществ – восстановителями. Чем дальше расположен металл в ряду напряжений, тем более сильным окислителем в водном растворе являются его ионы, и наоборот, чем ближе металл к началу ряда, тем более сильные восстановительные свойства проявляет простое вещество – металл.
Таким образом, ряд напряжений металлов не является отражением общей закономерности, он характеризует окислительно-восста-новительную способность электрохимической системы «металл ─ ион металла» в строго определенных условиях: приведенные в нем величины относятся к водному раствору, при температуре 25 °С
и единичной активности (концентрацией) ионов металла.
Таблица 3
Ряд напряжений металлов
| Окислитель | Уравнение электродного процесса |
| Восстановитель | Условная классификация восстановителей |
| 1 | 2 | 3 | 4 | 5 |
| Li+ |
| – 3,045 | Li | А – активный |
| Rb+ |
| – 2,925 | Rb | А |
| K+ |
| – 2,925 | K | А |
| Cs+ |
| – 2, 923 | Cs | А |
| Ca2+ |
| – 2,866 | Ca | А |
| Na+ |
| – 2,714 | Na | А |
| Mg2+ |
| – 2,363 | Mg | А |
Окончание табл. 3
| 1 | 2 | 3 | 4 | 5 |
| Al3+ |
| – 1,662 | Al | А |
| Ti2+ |
| – 1,628 | Ti | СА – средней активности |
| Mn2+ |
| – 1,180 | Mn | СА |
| Cr2+ |
| – 0,913 | Cr | СА |
| H2O |
| – 0,826 | H2, pH=14 | – |
| Zn2+ |
| – 0,763 | Zn | СА |
| Cr3+ |
| – 0,744 | Cr | СА |
| Fe2+ |
| – 0,440 | Fe | СА |
| H2O |
| – 0,413 | H2, pH=7 | – |
| Cd2+ |
| – 0,403 | Cd | СА |
| Co2+ |
| – 0,227 | Co | СА |
| Ni2+ |
| – 0,250 | Ni | СА |
| Sn2+ |
| – 0,136 | Sn | СА |
| Pb2+ |
| – 0,126 | Pb | СА |
| Fe3+ |
| – 0,036 | Fe | СА |
| H+ |
| H2, pH=0 | – | |
| Bi3+ |
| 0,215 | Bi | МА – малой активности |
| Cu2+ |
| 0,337 | Cu | МА |
| Cu+ |
| 0,521 | Cu | МА |
| Ag+ |
| 0,788 | Ag | МА |
| Hg2+ |
| 0,799 | Hg | МА |
| Pt2+ |
| 0,854 | Pt | МА |
| Au3+ |
| 1,2 | Au | МА |
| Au+ |
| 1,498 | Au | МА |
| МЕТАЛЛЫ | ||
| Активные | Средней активности | Малоактивные |
|
|
|
|
Ваша оценка?


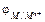 , В
, В