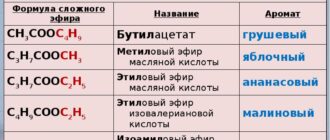
С точки зрения квантовой механики образование химических связей можно рассматривать как взаимодействие между электроном, поведение каждого из которых описывается пси-функцией, а образование химических связей будет пропорциональна взаимодействию ψ(a) и ψ(b).
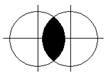 Математическое выражение:∫ ψ(a)ψ(b)dV – интеграл перекрывания.
Математическое выражение:∫ ψ(a)ψ(b)dV – интеграл перекрывания.
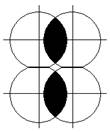 s -–орбитали пересекаются в плоскости в которой лежат ядра атомов. Такая связь называется сигма-связь (σ-связь). Но возможны и другие виды направления.
s -–орбитали пересекаются в плоскости в которой лежат ядра атомов. Такая связь называется сигма-связь (σ-связь). Но возможны и другие виды направления.
р – орбитали могут пересекаться в плоскости, перпендикулярной плоскости ядер. Это π-связь.
У d – орбиталей — дельта-связь.
Для расчета используют 2 метода:
1. Метод валентных связей;
2. Метод молекулярных орбиталей.
Общий смысл метода молекулярных орбиталей в том, что электроны в молекуле не принадлежат отдельным атомам. Они образуют общие молекулярные орбитали, число которых равно числу исходных атомов.
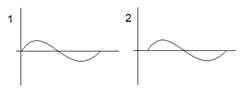 2 ψ-функции разных атомов.
2 ψ-функции разных атомов.
1. Усиливает (связывает) ψсв.=С1 ψа + С2 ψb
2. Разрыхляющая (*) ψр.=С1 ψа – С2 ψb
Энергия связывающих орбиталей ниже, чем энергия исходных атомов, а энергия разрыхл. – выше.
 Устойчивость молекул зависит от того, как велика разность между числом электронов на связывающей и разрыхляющей орбиталях. Вводиться спец. величина: порядок связи – n = (nсв. – nр.)/2.
Устойчивость молекул зависит от того, как велика разность между числом электронов на связывающей и разрыхляющей орбиталях. Вводиться спец. величина: порядок связи – n = (nсв. – nр.)/2.
Если порядок связывающей больше 0, то молекула существует.
С точки зрения методов молекулярной орбитали, можно объяснить не только устойчивость молекул, но и многие его свойства.
Молекула О2:
Ваша оценка?